题目内容
已知酸H2B在水溶液中存在下列关系:①H2B=H++HB-,②HB-?H++B2-,则下列说法中一定正确的是( )
| A、Na2B溶液中一定有:c(Na+)=2[c(B2-)+c(HB-)+c(H2B)] |
| B、Na2B溶液一定呈碱性,NaHB溶液可能呈酸性也可能呈碱性 |
| C、NaHB水溶液中一定有:c(Na+)+c(H+)=c(HB-)+c(OH-)+c(B2-) |
| D、在Na2B溶液中一定有:c(OH-)=c(H+)+c(HB-) |
考点:离子浓度大小的比较
专题:
分析:酸H2B在水溶液中第一步完全电离,第二步部分电离,所以B2-只能发生一步水解,
A.B2-只能发生一步水解,所以溶液中不存在H2B;
B.HB-在水溶液里只能电离不能水解,B2-只能发生一步水解;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
D.B2-只能发生一步水解,根据质子守恒.
A.B2-只能发生一步水解,所以溶液中不存在H2B;
B.HB-在水溶液里只能电离不能水解,B2-只能发生一步水解;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
D.B2-只能发生一步水解,根据质子守恒.
解答:
解:酸H2B在水溶液中第一步完全电离,第二步部分电离,所以B2-只能发生一步水解,
A.B2-只能发生一步水解,所以溶液中不存在H2B,故A错误;
B.HB-在水溶液里只能电离不能水解,B2-只能发生一步水解,所以NaHB溶液一定呈酸性,Na2B溶液一定呈碱性,故B错误;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(HB-)+c(OH-)+2c(B2-),故C错误;
D.在Na2B溶液中存在质子守恒c(OH-)=c(H+)+c(HB-),故D正确;
故选D.
A.B2-只能发生一步水解,所以溶液中不存在H2B,故A错误;
B.HB-在水溶液里只能电离不能水解,B2-只能发生一步水解,所以NaHB溶液一定呈酸性,Na2B溶液一定呈碱性,故B错误;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(HB-)+c(OH-)+2c(B2-),故C错误;
D.在Na2B溶液中存在质子守恒c(OH-)=c(H+)+c(HB-),故D正确;
故选D.
点评:本题考查离子浓度大小比较,明确该二元酸电离特点是解本题关键,再结合守恒思想解答,注意B2-只能发生一步水解,为易错点.

练习册系列答案
相关题目
根据物质的分类,水不属于( )
| A、氧化物 | B、单质 |
| C、化合物 | D、纯净物 |
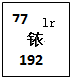 美国有个已经破产了的铱星公司,原来计划发射77颗卫星以实现全球卫星通讯,其公司名称和发射卫星计划数目取材于元素周期表中的铱元素(如图所示).
美国有个已经破产了的铱星公司,原来计划发射77颗卫星以实现全球卫星通讯,其公司名称和发射卫星计划数目取材于元素周期表中的铱元素(如图所示).以下说法正确的是( )
| A、铱原子核外有77个电子 |
| B、铱元素的原子构成了一种非金属化合物 |
| C、铱原子核中有192个中子 |
| D、铱元素的相对原子质量为77 |
下列几种类推结论中,正确的是( )
| A、由2Cu+O2═2CuO可推出同族的硫也有Cu+S═CuS |
| B、Fe3O4可表示为FeO?Fe2O3,则Pb3O4可表示为PbO?Pb2O3 |
| C、Na能与水反应生成H2,K、Ca也能与水反应生成H2 |
| D、CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应只生成Na2SO3和O2 |
下列关于有机物的说法正确的是( )
| A、乙烯和苯都能使溴水褪色,褪色的原因不相同 |
| B、苯中少量的苯酚可先加适量的浓溴水,使苯酚生成三溴苯酚,再过滤而除去 |
| C、苯的二氯代物有3种,说明苯分子是由6个碳原子以单双键交替结合而成的六元环结构 |
| D、乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |

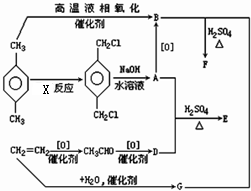 有机物E和F可用作塑料增塑剂或涂料中的溶剂,它们的分子量相等,可用以下方法合成:
有机物E和F可用作塑料增塑剂或涂料中的溶剂,它们的分子量相等,可用以下方法合成: