题目内容
用NA表示阿伏伽德罗常数,下列叙述不正确的是( )
| A、标准情况下,22.4LH2含有的分子数为1NA |
| B、常温常压下,1.06gNa2CO3(相对分子质量为106)含有的Na+离子数为0.02NA |
| C、常温常压下,6.02×1023个CO2分子占有的体积为22.4L |
| D、1L物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA |
考点:阿伏加德罗常数
专题:
分析:A.根据n=
计算出标况下氢气的物质的量,再计算出含有的分子数;
B.1.06g碳酸钠的物质的量为0.01mol,含有0.02mol钠离子;
C.常温常压下,不是标准状况下,不能使用标况下的气体摩尔体积计算二氧化碳的体积;
D.根据n=cv计算出氯化镁的物质的量,再计算出含有的氯离子的物质的量.
| V |
| 22.4L/mol |
B.1.06g碳酸钠的物质的量为0.01mol,含有0.02mol钠离子;
C.常温常压下,不是标准状况下,不能使用标况下的气体摩尔体积计算二氧化碳的体积;
D.根据n=cv计算出氯化镁的物质的量,再计算出含有的氯离子的物质的量.
解答:
解:A.标况下22.4L氢气的物质的量为1mol,含有的分子数为1NA,故A正确;
B.1.06g碳酸钠的物质的量为:
=0.01mol,0.01mol碳酸钠中含有0.02mol钠离子,含有的Na+离子数为0.02NA,故B正确;
C.6.02×1023个CO2分子的物质的量为1mol,不是标况下,不能使用标况下的气体摩尔体积计算1mol二氧化碳的体积,故C错误;
D.1L 0.5mol/L的氯化镁溶液中含有溶质氯化镁的物质的量为:0.5mol/L×1L=0.5mol,0.5mol氯化镁含有1mol氯离子,含有Cl-个数为1NA,故D正确;
故选C.
B.1.06g碳酸钠的物质的量为:
| 1.06g |
| 106g/mol |
C.6.02×1023个CO2分子的物质的量为1mol,不是标况下,不能使用标况下的气体摩尔体积计算1mol二氧化碳的体积,故C错误;
D.1L 0.5mol/L的氯化镁溶液中含有溶质氯化镁的物质的量为:0.5mol/L×1L=0.5mol,0.5mol氯化镁含有1mol氯离子,含有Cl-个数为1NA,故D正确;
故选C.
点评:本题考查阿伏加德罗常数的综合应用,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
核磁共振造影增强剂可用于疾病的诊断,还可以作为药物载体用于疾病的治疗.中科院化学研究所在用核磁共振造影剂进行肿瘤鉴别诊断研究方面取得重要进展,为磁性纳米晶体材料在生物医学领域的应用提供了更广泛的前景.制备纳米四氧化三铁的过程如下:下列有关叙述不合理的是( )


| A、纳米四氧化三铁具有磁性,作为药物载体用于疾病的治疗 |
| B、纳米四氧化三铁分散在适当溶剂中,它与淀粉溶液分散质微粒直径相当 |
| C、在反应②中环丙胺的作用是作还原剂 |
| D、反应③的化学方程式是6FeOOH+CO═2Fe3O4+3H2O+CO2 |
下列溶液中的c(Cl-)与50mL 1mol?L-1 AlCl3溶液中的c(Cl-)相等的是( )
| A、150 mL 1 mol?L-1氯化钠溶液 |
| B、75 mL 1 mol?L-1氯化亚铁溶液 |
| C、50 mL 3 mol?L-1氯酸钾溶液 |
| D、25 mL 1.5 mol?L-1氯化钙溶液 |
下列各物质的分类、名称(或俗名)、化学式都正确的是( )
| A、碱性氧化物 氧化铁 Fe3O4 |
| B、酸性氧化物 碳酸气 CO |
| C、酸 硫酸 H2S |
| D、盐 纯碱 Na2CO3 |
下列比较中,正确的是( )
| A、同温度同物质的量浓度时,HF比HCN电离平衡常数大,则NaF溶液的pH比NaCN溶液大 |
| B、0.2 mol?L-1 NH4Cl和0.1 mol?L-1 NaOH溶液等体积混合后:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+) |
| C、物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) |
| D、同浓度的下列溶液中,①NH4Al(SO4)2 ②NH4Cl ③CH3COONH4 ④NH3?H2O;c(NH4+) 由大到小的顺序是:③>②>①>④ |
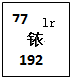 美国有个已经破产了的铱星公司,原来计划发射77颗卫星以实现全球卫星通讯,其公司名称和发射卫星计划数目取材于元素周期表中的铱元素(如图所示).
美国有个已经破产了的铱星公司,原来计划发射77颗卫星以实现全球卫星通讯,其公司名称和发射卫星计划数目取材于元素周期表中的铱元素(如图所示).以下说法正确的是( )
| A、铱原子核外有77个电子 |
| B、铱元素的原子构成了一种非金属化合物 |
| C、铱原子核中有192个中子 |
| D、铱元素的相对原子质量为77 |
 硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题,
硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题,