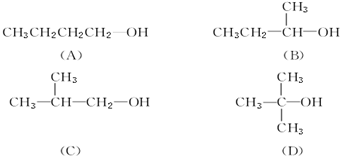题目内容
7.下表为元素周期表的一部分,请回答有关问题:| I A | IIA | ⅢA | IVA | VA | ⅥA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)表中最活泼的金属元素是K,非金属性最强的元素是F(用元素符号填写);
(3)写出⑦和⑨形成的化合物的电子式
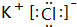
(4)①的氢化物与⑦的氢化物能够发生反应,写成形成盐M的电子式
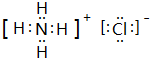 ,M中的化学键类型为离子键、共价键.
,M中的化学键类型为离子键、共价键.(5)表中形成两性氢氧化物的元素是Al(用元素符号填写),写出该元素的氢氧化物分别与⑥、⑨的最高价氧化物对应水化物反应的离子方程式:Al(OH)3+3H+═Al3++3H2O,Al(OH)3+OH-═AlO2-+2H2O.
分析 (1)由元素在周期表中的位置可知,①是N,②是F,③是Mg,④是Al,⑤是Si,⑥是S,⑦是Cl,⑧是Ar,⑨是K,⑩是Br;
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,稀有气体的性质最不活泼;
(3)⑦和⑨形成的化合物为KCl,由钾离子与氯离子构成;
(4)①的氢化物与⑦的氢化物反应形成盐M为NH4Cl;
(5)氢氧化铝是两性氢氧化物,⑥、⑨的最高价氧化物对应水化物分别为硫酸、KOH,氢氧化铝与硫酸氟生成硫酸铝与水,氢氧化铝与氢氧化钾反应生成偏铝酸钾与水.
解答 解:(1)由元素在周期表中的位置可知,①是N,②是F,③是Mg,④是Al,⑤是Si,⑥是S,⑦是Cl,⑧是Ar,⑨是K,⑩是Br,
故答案为:Si;Ar;
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,稀有气体的性质最不活泼,故最活泼的金属元素是K,非金属性最强的元素是F,
故答案为:K;F;
(3)⑦和⑨形成的化合物为KCl,由钾离子与氯离子构成,电子式为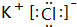 ,
,
故答案为: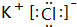 ;
;
(4)①的氢化物与⑦的氢化物反应形成盐M为NH4Cl,电子式为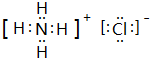 ,含有离子键、共价键,
,含有离子键、共价键,
故答案为: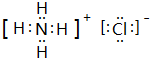 ;离子键、共价键;
;离子键、共价键;
(5)表中形成两性氢氧化物的元素是Al,⑥、⑨的最高价氧化物对应水化物分别为硫酸、KOH,氢氧化铝与硫酸氟生成硫酸铝与水,反应离子方程式为Al(OH)3+3H+═Al3++3H2O,氢氧化铝与氢氧化钾反应生成偏铝酸钾与水,反应离子方程式为Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al;Al(OH)3+3H+═Al3++3H2O、Al(OH)3+OH-═AlO2-+2H2O.
点评 本题考查了元素周期表和元素周期律综合应用,侧重对化学用语的考查,注意对元素周期律与元素化合物知识的掌握.

| A. | 0.2 mol | B. | 0.5 mol | C. | 2 mol | D. | 5 mol |
| A. | 中子数为18的氯原子${\;}_{17}^{37}$Cl | B. | 硫离子的结构示意图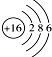 | ||
| C. | 过氧化钠的电子式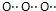 | D. | HClO的结构式H-O-Cl |
| A. | 若2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol,则H2燃烧热为241.8 kJ/mol | |
| B. | 若P4(白磷,s)=4P(红磷,s)△H=-29.2kJ/mol,则红磷比白磷稳定 | |
| C. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.4 kJ/mol,则20.0g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
| A. | 甲苯能与浓硝酸浓硫酸反应生成三硝基甲苯 | |
| B. | 1 mol甲苯能与3 mol H2发生加成反应 | |
| C. | 甲苯能使酸性高锰酸钾褪色 | |
| D. | 甲苯能燃烧产生带浓烟的火焰 |
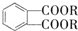 (代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
(代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
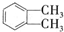 的名称1,2-二甲苯(或邻二甲苯),C中官能团的名称为醛基,DMP的分子式为C10H10O4.
的名称1,2-二甲苯(或邻二甲苯),C中官能团的名称为醛基,DMP的分子式为C10H10O4.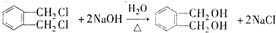 .
. .
.