题目内容
15.下列对物质的结构组成表示正确的是( )| A. | 中子数为18的氯原子${\;}_{17}^{37}$Cl | B. | 硫离子的结构示意图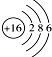 | ||
| C. | 过氧化钠的电子式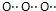 | D. | HClO的结构式H-O-Cl |
分析 A、氯原子的核电荷数为17,该氯原子的质量数为35,元素符号的左上角表示质量数,左下角为质子数;
B、硫离子的核外有18个电子;
C、过氧化钠是由2个钠离子与1个过氧根离子通过离子键结合而成的离子化合物;
D、HClO分子中O形成2对共用电子对.
解答 解:A、中子数为18的氯原子的质量数为35,该氯原子正确的表示方法为:1735Cl,故A错误;
B、硫离子的核外有18个电子,核内有16个质子,故硫离子的结构示意图为 ,故B错误;
,故B错误;
C、过氧化钠是由2个钠离子与1个过氧根离子通过离子键结合而成的离子化合物,电子式为 ,是由Na+与O22-构成的,故C错误;
,是由Na+与O22-构成的,故C错误;
D、HClO分子中O形成2对共用电子对,则HClO分子的结构式为H-O-Cl,故D正确;
故选D.
点评 本题考查化学用语,为高频考点,涉及电子式、结构示意图、结构式、原子的表示等,注意化学用语的区别及规范应用,侧重基础知识的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.截至1999年,人们已经发现了113种( )
| A. | 原子 | B. | 分子 | C. | 核素 | D. | 元素 |
6.将29.5g乙烷和乙烯的混合气体通入足量的溴水后,溴水质量增加7g,则混合气体中乙烯的体积分数是( )
| A. | 21% | B. | 25% | C. | 30% | D. | 35% |
3.下列关于元素周期表的叙述,错误的是( )
| A. | 元素周期表揭示了化学元素间的内在联系,是化学发展史上重要里程碑 | |
| B. | 在周期表中,把电子层数相同的元素排成一横行,称为一周期 | |
| C. | 元素周期表中,总共有18个纵行,18个族,IIIB族含有32种金属元素 | |
| D. | 第IA族(除H)元素又称为碱金属元素,第ⅦA族元素又称为卤族元素 |
10.下列说法正确的是( )
| A. | KOH和CaCl2既含有离子键,又含有共价键 | |
| B. | PH3各原子均满足8电子稳定结构 | |
| C. | 硫离子的结构示意图: | |
| D. | NH4Cl的电子式: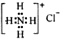 |
20.碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示,下列说法错误的是( )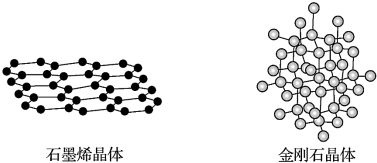

| A. | 在石墨烯晶体中,每个C原子连接3个六元环 | |
| B. | 在石墨烯晶体中,每个六元环占有3个C原子 | |
| C. | 在金刚石晶体中,C原子所连接的最小环为六元环,每个7C原子连接12个六元环 | |
| D. | 在金刚石晶体中,六元环中最多有4个C原子在同一平面 |
7.下表为元素周期表的一部分,请回答有关问题:
(1)⑤和⑧的元素符号是Si和Ar;
(2)表中最活泼的金属元素是K,非金属性最强的元素是F(用元素符号填写);
(3)写出⑦和⑨形成的化合物的电子式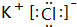
(4)①的氢化物与⑦的氢化物能够发生反应,写成形成盐M的电子式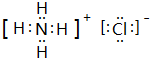 ,M中的化学键类型为离子键、共价键.
,M中的化学键类型为离子键、共价键.
(5)表中形成两性氢氧化物的元素是Al(用元素符号填写),写出该元素的氢氧化物分别与⑥、⑨的最高价氧化物对应水化物反应的离子方程式:Al(OH)3+3H+═Al3++3H2O,Al(OH)3+OH-═AlO2-+2H2O.
| I A | IIA | ⅢA | IVA | VA | ⅥA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)表中最活泼的金属元素是K,非金属性最强的元素是F(用元素符号填写);
(3)写出⑦和⑨形成的化合物的电子式
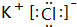
(4)①的氢化物与⑦的氢化物能够发生反应,写成形成盐M的电子式
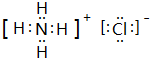 ,M中的化学键类型为离子键、共价键.
,M中的化学键类型为离子键、共价键.(5)表中形成两性氢氧化物的元素是Al(用元素符号填写),写出该元素的氢氧化物分别与⑥、⑨的最高价氧化物对应水化物反应的离子方程式:Al(OH)3+3H+═Al3++3H2O,Al(OH)3+OH-═AlO2-+2H2O.
4.同周期的三种元素X、Y、Z,已知最高价氧化物的水化物酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则下列判断正确的是( )
| A. | 非金属性 Z>Y>X | B. | 原子半径 X>Y>Z | ||
| C. | 气态氢化物的稳定性 X>Y>Z | D. | 原子最外层电子数Z>Y>X |
 某化学兴趣小组为探究元素性质的递变规律,设计可如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计可如下系列实验.