题目内容
101kPa时辛烷的燃烧热为5518kJ?mol-1,强酸与强碱在稀溶液中发生反应时的中和热为57.3kJ?mol-1,则下列热化学方程式书写正确的是( )
A、C8H18(1)+
| ||||
B、C8H18(1)+
| ||||
| C、H+(aq)+OH-(aq)═H2O(aq);△H=一57.3 kJ?mol-1 | ||||
D、NaOH(aq)+
|
考点:热化学方程式
专题:化学反应中的能量变化
分析:根据燃烧热是1mol可燃物完全反应生成稳定氧化物时放出的热量;
中和热是强酸与强碱的稀溶液发生中和反应生成1mol水时放出的热量来分析.
中和热是强酸与强碱的稀溶液发生中和反应生成1mol水时放出的热量来分析.
解答:
解:A、燃烧反应是放热反应,△H=-5518kJ?mol-1,故A错误;
B、符合燃烧热的概念,故B正确;
C、符合中和热概念,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ?mol-1,故C正确;
D、中和反应是放热反应,△H=-57.3kJ?mol-1,故D错误;
故选:BC.
B、符合燃烧热的概念,故B正确;
C、符合中和热概念,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ?mol-1,故C正确;
D、中和反应是放热反应,△H=-57.3kJ?mol-1,故D错误;
故选:BC.
点评:本题考查了中和热、燃烧热的概念应用,注意对中和热、燃烧热内涵理解是解题关键,难度不大.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
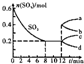 在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示.下列判断正确的是( )
在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示.下列判断正确的是( )| A、用O2表示0~8 min内该反应的平均速率为0.025 mol?(L?min)-1 |
| B、升高温度,达到新平衡时的化学平衡常数比原平衡的小 |
| C、容器内压强保持不变时反应处于平衡状态 |
| D、第12min时,容器压强到1L,则SO3的变化曲线为a |
将锌片和铜片用导线连接置于稀硫酸溶液中,下列叙述错误的是( )
| A、锌片做负极,锌发生还原反应 |
| B、铜片做正极 |
| C、溶液中的pH值增大 |
| D、溶液中的H+向正极移动 |
反应3Cl2+6KOH(浓)═KClO3+5KCl+3H2O中,氧化剂和还原剂的物质的量比( )
| A、5:1 | B、4:1 |
| C、1:5 | D、1:4 |
下列有关物质的保存方法,不正确的是( )
| A、液氯储存在钢瓶中 |
| B、浓硫酸储存在铝制容器中 |
| C、金属钠保存在煤油中 |
| D、氢氧化钠溶液保存在带玻璃塞的玻璃试剂瓶中 |
有机物 的系统命名正确的是( )
的系统命名正确的是( )
 的系统命名正确的是( )
的系统命名正确的是( )| A、2,4,4-三甲基己烷 |
| B、2,4-二甲基-2-乙基戊烷 |
| C、3,3,5-三甲基已烷 |
| D、2,4-二甲基-4-乙基戊烷 |
设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A、7.8 g过氧化钠与足量二氧化碳反应转移的电子数为0.1NA |
| B、1 mol?L-1的碳酸钠溶液中含有CO32-的数目小于NA |
| C、标准状况下,2.24LCl2溶于水,转移的电子数目为0.1NA |
| D、1molNa被完全氧化生成Na2O2,失去个2 NA电子 |