题目内容
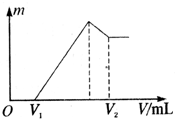 将0.1mol的镁、铝混合物溶于100mL 2mol?L-1的H2SO4溶液中,然后再滴1mol?L-1的NaOH溶液.请回答:(不需要写出计算过程)
将0.1mol的镁、铝混合物溶于100mL 2mol?L-1的H2SO4溶液中,然后再滴1mol?L-1的NaOH溶液.请回答:(不需要写出计算过程)(1)若在滴加NaOH溶液的过程中沉淀质量m随加入NaOH溶液的体积V变化如图所示.当V1=160mL时,则金属粉末中n(Mg)=
(2)①要配制100mL 2mol?L-1的H2SO4溶液,需要的仪器除量筒、烧杯外,还有
②下列操作会使所配的溶液浓度偏小的是
A.用量筒量取一定体积的98%的浓H2SO4,稀释后未经冷却即转入容量瓶内
B.稀释硫酸所用的小烧杯未洗涤
C.定容时俯视液面
D.用蒸馏水洗涤后的容量瓶未干燥
E.定容摇匀后,倒入干燥的试剂瓶中储存时,有少量溶液浅出瓶外.
考点:有关混合物反应的计算,镁、铝的重要化合物,配制一定物质的量浓度的溶液
专题:
分析:(1)根据图象可知,在滴加NaOH溶液到体积V1=160mL过程中,没有沉淀生成,说明硫酸有剩余,滴加的NaOH用于中和剩余硫酸,V1=160mL时,剩余的H2SO4与滴加的NaOH恰好完全反应,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,根据Mg原子、Al原子、SO42-离子、Na+离子守恒,列方程求算n(Mg);
当滴加NaOH溶液到体积V2时,Al(OH)3完全溶解,沉淀是Mg(OH)2,溶液是Na2SO4和NaAlO2混合液.根据SO42-离子、Na+离子和Al原子守恒,求出n(NaOH),再利用V=
计算;
(2)①根据配制溶液的实验操作过程选择所需的仪器;
②分析操作对溶质的物质的量或对溶液的体积的影响,根据c=
分析判断;
当滴加NaOH溶液到体积V2时,Al(OH)3完全溶解,沉淀是Mg(OH)2,溶液是Na2SO4和NaAlO2混合液.根据SO42-离子、Na+离子和Al原子守恒,求出n(NaOH),再利用V=
| n |
| c |
(2)①根据配制溶液的实验操作过程选择所需的仪器;
②分析操作对溶质的物质的量或对溶液的体积的影响,根据c=
| n |
| V |
解答:
解:(1)当V1=160mL时,此时,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,
由Na+离子守恒可知,n(Na2SO4)=
n(Na+)=
n(NaOH)=
×0.16L×1mol/L=0.08mol
设MgSO4的物质的量为xmol、Al2(SO4)3为ymol,则:
根据Mg原子、Al原子守恒有:①x+2y=0.1,
根据SO42-离子守恒有:②x+3y=0.2-0.08,
联立方程①②解得:x=0.06;y=0.02,
所以金属粉末中:n(Mg)=0.06mol、n(Al)=2y=2×0.02mol=0.04mol
滴加NaOH溶液到体积V2时时,溶液是Na2SO4和NaAlO2混合液,根据SO42-离子、Na+离子和Al原子守恒有:
n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al)=2×0.1L×2mol/L×+0.04mol=0.44mol,
所以,V2=
=0.44L=440ml,
故答案为:0.06mol,440 mL;
(2)配制步骤有:计算、量取、稀释、移液、洗涤、定容、摇匀、装瓶、贴签等操作,一般用量筒量取(还需胶头滴管),在烧杯中溶解,冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤并将洗涤液移入容量瓶,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,振荡、摇匀后,装瓶、贴签.所以需要的仪器为:玻璃棒、烧杯、胶头滴管、量筒、100mL容量瓶,还需要的仪器有:玻璃棒、100mL容量瓶、胶头滴管,
故答案为:玻璃棒、100mL容量瓶、胶头滴管;
②A、用量筒量取一定体积的98%的浓硫酸,稀释后未经冷却即转入容量瓶内,热溶液的体积偏大,一但冷却下来,溶液的体积偏小,浓度偏大,故A不错误;
B、稀释硫酸所用的小烧杯未洗涤,因烧杯内壁沾有溶质,所以溶质的质量偏小,浓度偏小,故B正确;
C、定容时俯视观察液面,溶液的液面低于刻度线,溶液的体积偏小,浓度偏大,故C错误;
D、用蒸馏水洗涤后的容量瓶未干燥,对溶液的体积无影响,浓度不变,故D错误;
E、定容摇匀后,倒入干燥的试剂瓶中储存时,有少量溶液溅出瓶外,由于是均匀的溶液,对溶液的浓度无影响,故E错误;
故答案为:B.
由Na+离子守恒可知,n(Na2SO4)=
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
设MgSO4的物质的量为xmol、Al2(SO4)3为ymol,则:
根据Mg原子、Al原子守恒有:①x+2y=0.1,
根据SO42-离子守恒有:②x+3y=0.2-0.08,
联立方程①②解得:x=0.06;y=0.02,
所以金属粉末中:n(Mg)=0.06mol、n(Al)=2y=2×0.02mol=0.04mol
滴加NaOH溶液到体积V2时时,溶液是Na2SO4和NaAlO2混合液,根据SO42-离子、Na+离子和Al原子守恒有:
n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al)=2×0.1L×2mol/L×+0.04mol=0.44mol,
所以,V2=
| 0.44mol |
| 1mol/L |
故答案为:0.06mol,440 mL;
(2)配制步骤有:计算、量取、稀释、移液、洗涤、定容、摇匀、装瓶、贴签等操作,一般用量筒量取(还需胶头滴管),在烧杯中溶解,冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤并将洗涤液移入容量瓶,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,振荡、摇匀后,装瓶、贴签.所以需要的仪器为:玻璃棒、烧杯、胶头滴管、量筒、100mL容量瓶,还需要的仪器有:玻璃棒、100mL容量瓶、胶头滴管,
故答案为:玻璃棒、100mL容量瓶、胶头滴管;
②A、用量筒量取一定体积的98%的浓硫酸,稀释后未经冷却即转入容量瓶内,热溶液的体积偏大,一但冷却下来,溶液的体积偏小,浓度偏大,故A不错误;
B、稀释硫酸所用的小烧杯未洗涤,因烧杯内壁沾有溶质,所以溶质的质量偏小,浓度偏小,故B正确;
C、定容时俯视观察液面,溶液的液面低于刻度线,溶液的体积偏小,浓度偏大,故C错误;
D、用蒸馏水洗涤后的容量瓶未干燥,对溶液的体积无影响,浓度不变,故D错误;
E、定容摇匀后,倒入干燥的试剂瓶中储存时,有少量溶液溅出瓶外,由于是均匀的溶液,对溶液的浓度无影响,故E错误;
故答案为:B.
点评:本题考查了有关混合物反应的计算、配制一定物质的量浓度的溶液方法,题目难度中等,注意掌握配制一定物质的量浓度的溶液方法,明确有关混合物反应的化学计算方法,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
相关题目
关于从碘水中分离出碘单质的实验,下列说法正确的是( )
| A、可以用酒精萃取出碘单质 |
| B、可以用CCl4萃取出碘单质,理由是CCl4密度比水大 |
| C、若用CCl4萃取出碘单质,萃取后下层液体呈紫红色 |
| D、若用CCl4萃取出碘单质,萃取后无色液体层应从分液漏斗的上口倒出 |
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A、0.1mol?L-1的NaF溶液中所含F-的数目小于0.1NA |
| B、标准情况下,2.24L乙醇中含有的C-H键数目为0.5NA |
| C、0.1mol Na完全被氧化生成Na2O2,转移电子的数目为NA |
| D、0.1mol O2中含氧原子数目为0.2NA |
下列说法错误的是( )
| A、常温下,若醋酸钠与醋酸的混合溶液pH=7,则C(Na+)=c(CH3COO-) |
| B、某温度下,pH=6的NaCl溶液中离子浓度的大小关系:c(Na+)=c(Cl-)>c(H+)>c(OH-) |
| C、若2a mol?L-1HCN与a mol?L-1 NaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则混合溶液pH>7 |
| D、含0.1 mol NaHCO3和0.2molNa2CO3的混合液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
 现有部分前四周期7种元素,原子序数依次增大,它们的性质或原子结构如下表:
现有部分前四周期7种元素,原子序数依次增大,它们的性质或原子结构如下表: