题目内容
某主族元素R的单质可被稀硝酸氧化为R3+,R3+最外层有两个电子,在氢氧化钠溶液条件下,R3+可被氯气氧化成带一个单位负电荷的含氧酸根阴离子并转化为钠盐X;该钠盐在酸性条件下能将Mn2+氧化成MnO4-,同时本身又被还原为R3+.回答有关问题(元素符号就用R,不必写出具体的元素)
(1)R是元素周期表中 族元素,其最高价氧化物对应水化物所形成的钠盐X的化学式是 ,R属于 (填“金属”或“非金属”)元素.
(2)若R元素最高价氧化物对应水化物所形成的钠盐X是一种难溶于水的物质,试写出下列反应的离子方程式(元素符号就用R):
①氢氧化钠条件下R3+与氯气反应: ;
②酸性条件下该钠盐与Mn2+反应: ;
③根据①中反应可得出钠盐X的氧化性比氯气 ,根据②中反应可得出钠盐X的氧化性比MnO4- , (填“能”或“不能”)由此得出氯气的氧化性比MnO4-强,理由是 .
(1)R是元素周期表中
(2)若R元素最高价氧化物对应水化物所形成的钠盐X是一种难溶于水的物质,试写出下列反应的离子方程式(元素符号就用R):
①氢氧化钠条件下R3+与氯气反应:
②酸性条件下该钠盐与Mn2+反应:
③根据①中反应可得出钠盐X的氧化性比氯气
考点:位置结构性质的相互关系应用
专题:
分析:(1)R3+最外层有两个电子,说明R原子最外层有5个电子,它是主族元素,所以它在第ⅤA族,所以它的最高正价应为+5价,所以R的一个单位负电荷的含氧酸根阴离子为RO3-,由于R在溶液中存在简单的阳离子R3+,所以R为金属元素,据此答题;
(2)根据题中的条件和元素守恒、电荷守恒可写出①②中的离子反应,③根据氧化还原反应中氧化剂的氧化性强于氧化产物,判断氧化性强弱,同时考虑反应条件答题.
(2)根据题中的条件和元素守恒、电荷守恒可写出①②中的离子反应,③根据氧化还原反应中氧化剂的氧化性强于氧化产物,判断氧化性强弱,同时考虑反应条件答题.
解答:
解:(1)R3+最外层有两个电子,说明R原子最外层有5个电子,它是主族元素,所以它在第ⅤA族,所以它的最高正价应为+5价,所以R的一个单位负电荷的含氧酸根阴离子为RO3-,X的化学式为NaRO3,由于R在溶液中存在简单的阳离子R3+,所以R为金属元素,
故答案为:ⅤA族;NaRO3;金属;
(2)①在氢氧化钠溶液条件下,R3+可被氯气氧化成NaRO3,氯气则被还原成氯离子,离子方程式为R3++Cl2+Na++6OH-=NaRO3↓+2Cl-+3H2O,
故答案为:R3++Cl2+Na++6OH-=NaRO3↓+2Cl-+3H2O;
②NaRO3在酸性条件下能将Mn2+氧化成MnO4-,同时本身又被还原为R3+,离子方程式为5NaRO3+2Mn2++14H+=2MnO4-+5R3++5Na++7H2O,
故答案为:5NaRO3+2Mn2++14H+=2MnO4-+5R3++5Na++7H2O;
③根据氧化还原反应中氧化剂的氧化性强于氧化产物,并根据①中反应可得出钠盐X的氧化性比氯气 弱,根据②中反应可得出钠盐X的氧化性比MnO4- 强,但不能由此得出氯气的氧化性比MnO4-强,因为这两个反应环境不同,没有可比性,
故答案为:弱;强;不能;这两个反应环境不同,没有可比性.
故答案为:ⅤA族;NaRO3;金属;
(2)①在氢氧化钠溶液条件下,R3+可被氯气氧化成NaRO3,氯气则被还原成氯离子,离子方程式为R3++Cl2+Na++6OH-=NaRO3↓+2Cl-+3H2O,
故答案为:R3++Cl2+Na++6OH-=NaRO3↓+2Cl-+3H2O;
②NaRO3在酸性条件下能将Mn2+氧化成MnO4-,同时本身又被还原为R3+,离子方程式为5NaRO3+2Mn2++14H+=2MnO4-+5R3++5Na++7H2O,
故答案为:5NaRO3+2Mn2++14H+=2MnO4-+5R3++5Na++7H2O;
③根据氧化还原反应中氧化剂的氧化性强于氧化产物,并根据①中反应可得出钠盐X的氧化性比氯气 弱,根据②中反应可得出钠盐X的氧化性比MnO4- 强,但不能由此得出氯气的氧化性比MnO4-强,因为这两个反应环境不同,没有可比性,
故答案为:弱;强;不能;这两个反应环境不同,没有可比性.
点评:本题主要考查了原子结构和元素的性质及氧化还原反应的原理,中等难度,解题时注意基础本原理的应用和化学用语的规范表达.

练习册系列答案
相关题目
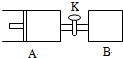 如图,向A中充入1molX、1molY,向B中充入2molX、2molY,起始时A、B的体积相等都等于aL,在相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g);△H<0.A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL.下列说法错误的是( )
如图,向A中充入1molX、1molY,向B中充入2molX、2molY,起始时A、B的体积相等都等于aL,在相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g);△H<0.A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL.下列说法错误的是( )| A、反应速率:v(B)>v(A) |
| B、A容器中X的转化率为80% |
| C、平衡时的压强:PB=2PA |
| D、平衡时Y的体积分数:A<B |
Cu与浓硝酸发生如下反应;Cu+4HNO3═Cu﹙NO3﹚2+2NO2↑+2H2O,被63.5铜还原的硝酸的质量是( )
| A、63g | B、126g |
| C、189g | D、252g |
下列关于Fe(OH)3胶体的制备,正确的操作是( )
| A、将FeCl3溶液滴入蒸馏水中即可 |
| B、将FeCl3溶液滴入热水中,得到黄色液体即可 |
| C、将FeCl3溶液滴入沸水中,得到红褐色液体即可 |
| D、将FeCl3溶液滴入沸水中,并继续加热煮沸至生成红褐色沉淀即可 |
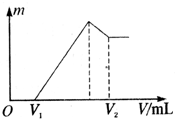 将0.1mol的镁、铝混合物溶于100mL 2mol?L-1的H2SO4溶液中,然后再滴1mol?L-1的NaOH溶液.请回答:(不需要写出计算过程)
将0.1mol的镁、铝混合物溶于100mL 2mol?L-1的H2SO4溶液中,然后再滴1mol?L-1的NaOH溶液.请回答:(不需要写出计算过程)