题目内容
实验室利用废旧锌锰电池来制备纳米级ZnO,一种方法如下:
取废旧锌锰电池5节,拆开,把锌皮煮沸后刷净晾干;剪碎放入烧杯中,在室温下,用硫酸溶解;待锌皮完全溶解,抽滤除去杂质;将滤液与A溶液反应制得ZnCO3后,高温分解,即可得纳米级ZnO.
回答下列问题:
(1)溶解锌皮时,用不同浓度硫酸、溶解时间和硫酸锌产率的关系见下表.由表可知,室温下溶解锌皮时硫酸的事宜浓度为 mol?L-1.溶解锌皮时硫酸用量不宜过多,其原因是 .
表1 硫酸浓度对锌溶解时间和硫酸锌产率的影响
(2)①制备ZnCO3时,原料A选(NH4)2CO3溶液而不用Na2CO3溶液的原因 .
②生成的ZnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是 .
(3)ZnCO3在封闭的高温电炉中焙烧,焙烧后的ZnO粉末用去离子水洗净,再用乙醇洗涤3次,减压过滤,干燥,得到纯净的纳米级ZnO.
①用乙醇洗涤的目的是 .
②焙烧5小时后,ZnCO3的分解速率随分解时间的延长而增加的幅度缓慢,其主要原因为 .
取废旧锌锰电池5节,拆开,把锌皮煮沸后刷净晾干;剪碎放入烧杯中,在室温下,用硫酸溶解;待锌皮完全溶解,抽滤除去杂质;将滤液与A溶液反应制得ZnCO3后,高温分解,即可得纳米级ZnO.
回答下列问题:
(1)溶解锌皮时,用不同浓度硫酸、溶解时间和硫酸锌产率的关系见下表.由表可知,室温下溶解锌皮时硫酸的事宜浓度为
表1 硫酸浓度对锌溶解时间和硫酸锌产率的影响
| 实验编号 | 锌皮质量/g | 硫酸浓度/(mol?L-1) | 酸用量/mL | 溶解耗时/h | ZnSO4?7H2O产率 |
| 1 | 11.1 | 6 | 34 | >24 | 88.83 |
| 2 | 12.0 | 4 | 56 | 11 | 88.92 |
| 3 | 12.0 | 3 | 72 | 5 | 91.54 |
| 4 | 12.6 | 2 | 107 | >24 | 91.33 |
②生成的ZnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是
(3)ZnCO3在封闭的高温电炉中焙烧,焙烧后的ZnO粉末用去离子水洗净,再用乙醇洗涤3次,减压过滤,干燥,得到纯净的纳米级ZnO.
①用乙醇洗涤的目的是
②焙烧5小时后,ZnCO3的分解速率随分解时间的延长而增加的幅度缓慢,其主要原因为
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:(1)分析图表数据可知硫酸锌晶体在硫酸浓度为3mol/L时产率最大;分析过程可知生成碳酸锌需要加入A溶液为碳酸铵,硫酸过量会消耗更多的硫酸铵;
(2)①Na2CO3溶液碱性强于碳酸铵溶液,会促进锌离子水解生成氢氧化锌;
②取洗涤液检验硫酸根离子的存在;
(3)①乙醇易挥发,氧化锌不溶于乙醇,有利于干燥减少损失;
②依据化学平衡原理分析判断;
(2)①Na2CO3溶液碱性强于碳酸铵溶液,会促进锌离子水解生成氢氧化锌;
②取洗涤液检验硫酸根离子的存在;
(3)①乙醇易挥发,氧化锌不溶于乙醇,有利于干燥减少损失;
②依据化学平衡原理分析判断;
解答:
解:(1)分析图表数据可知硫酸锌晶体在硫酸浓度为3mol/L时产率最大;把锌皮煮沸后刷净晾干;剪碎放入烧杯中,在室温下,用硫酸溶解;待锌皮完全溶解,抽滤除去杂质;将滤液与A溶液反应制得ZnCO3后,高温分解,即可得纳米级ZnO,过程可知生成碳酸锌需要加入A溶液为碳酸铵,硫酸过量会消耗更多的硫酸铵,造成浪费;
故答案为:3,硫酸过量会消耗更多的硫酸铵,造成浪费;
(2)①制备ZnCO3时,原料A选(NH4)2CO3溶液而不用Na2CO3溶液的原因是Na2CO3溶液比碳酸铵碱性强,会促进锌离子水解生成氢氧化锌;
故答案为:Na2CO3溶液碱性比碳酸铵强,会促进锌离子水解生成氢氧化锌;
②生成的ZnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是取洗涤液检验硫酸根离子的存在,取最后一次洗涤液,先加盐酸,然后加BaCl2溶液,若无沉淀生成则已洗净;
故答案为:取最后一次洗涤液,先加盐酸,然后加BaCl2溶液,若无沉淀生成则已洗净;
(3)①ZnCO3在封闭的高温电炉中焙烧,焙烧后的ZnO粉末用去离子水洗净,再用乙醇洗涤3次,用乙醇洗涤的目的是乙醇易挥发,氧化锌不溶于乙醇,有利于干燥减少损失;
故答案为:乙醇易挥发,有利于Zn粉末的干燥;
②依据化学平衡原理分析判断,焙烧5小时后,ZnCO3的分解速率随分解时间的延长而增加的幅度缓慢,其主要原因为反应ZnCO3(s)=ZnO(s)+CO2(g),生成大量二氧化碳趋于平衡;
故答案为:反应ZnCO3(s)=ZnO(s)+CO2(g),生成大量二氧化碳趋于平衡;
故答案为:3,硫酸过量会消耗更多的硫酸铵,造成浪费;
(2)①制备ZnCO3时,原料A选(NH4)2CO3溶液而不用Na2CO3溶液的原因是Na2CO3溶液比碳酸铵碱性强,会促进锌离子水解生成氢氧化锌;
故答案为:Na2CO3溶液碱性比碳酸铵强,会促进锌离子水解生成氢氧化锌;
②生成的ZnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是取洗涤液检验硫酸根离子的存在,取最后一次洗涤液,先加盐酸,然后加BaCl2溶液,若无沉淀生成则已洗净;
故答案为:取最后一次洗涤液,先加盐酸,然后加BaCl2溶液,若无沉淀生成则已洗净;
(3)①ZnCO3在封闭的高温电炉中焙烧,焙烧后的ZnO粉末用去离子水洗净,再用乙醇洗涤3次,用乙醇洗涤的目的是乙醇易挥发,氧化锌不溶于乙醇,有利于干燥减少损失;
故答案为:乙醇易挥发,有利于Zn粉末的干燥;
②依据化学平衡原理分析判断,焙烧5小时后,ZnCO3的分解速率随分解时间的延长而增加的幅度缓慢,其主要原因为反应ZnCO3(s)=ZnO(s)+CO2(g),生成大量二氧化碳趋于平衡;
故答案为:反应ZnCO3(s)=ZnO(s)+CO2(g),生成大量二氧化碳趋于平衡;
点评:本题考查了物质分离提纯方法,实验基本操作的分析应用,注意分析题干信息掌握基础是关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列关于Fe(OH)3胶体的制备,正确的操作是( )
| A、将FeCl3溶液滴入蒸馏水中即可 |
| B、将FeCl3溶液滴入热水中,得到黄色液体即可 |
| C、将FeCl3溶液滴入沸水中,得到红褐色液体即可 |
| D、将FeCl3溶液滴入沸水中,并继续加热煮沸至生成红褐色沉淀即可 |
下列不属于置换反应的是( )
A、CuO+H2
| ||||
B、C+2CuO
| ||||
C、Fe2O3+3CO2
| ||||
| D、Fe+CuSO4=FeSO4+Cu |
 如图为可逆反应:A(s)+D(g)?E(g);△H<0的逆反应速率随时间变化情况,试根据图中曲线判断下列说法中不正确的是( )
如图为可逆反应:A(s)+D(g)?E(g);△H<0的逆反应速率随时间变化情况,试根据图中曲线判断下列说法中不正确的是( )| A、t3时刻可能采取的措施是减小c(D) |
| B、t5时刻可能采取的措施是降温 |
| C、t7时刻可能采取的措施是减小压强 |
| D、t5~t6时间段平衡向逆反应方向移动 |
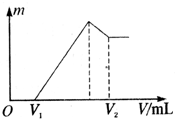 将0.1mol的镁、铝混合物溶于100mL 2mol?L-1的H2SO4溶液中,然后再滴1mol?L-1的NaOH溶液.请回答:(不需要写出计算过程)
将0.1mol的镁、铝混合物溶于100mL 2mol?L-1的H2SO4溶液中,然后再滴1mol?L-1的NaOH溶液.请回答:(不需要写出计算过程)
 我国支持“人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是
我国支持“人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是