题目内容
下列说法错误的是( )
| A、常温下,若醋酸钠与醋酸的混合溶液pH=7,则C(Na+)=c(CH3COO-) |
| B、某温度下,pH=6的NaCl溶液中离子浓度的大小关系:c(Na+)=c(Cl-)>c(H+)>c(OH-) |
| C、若2a mol?L-1HCN与a mol?L-1 NaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则混合溶液pH>7 |
| D、含0.1 mol NaHCO3和0.2molNa2CO3的混合液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
考点:离子浓度大小的比较
专题:
分析:A、醋酸与醋酸钠的pH=7,则c(OH-)=c(H+),再结合电荷守恒判断c(CH3COO-)、c(Na+)的相对大小;
B、某温度下,pH=6的NaCl溶液仍是中性溶液;
C、若2a mol?L-1HCN与a mol?L-1 NaOH溶液等体积混合后所得溶液是HCN和NaCN的混合液,溶液中c(Na+)>c(CN-),根据电荷守恒确定氢离子和氢氧根离子浓度的大小,判断酸碱性;
D、根据溶液中的电荷守恒来回答判断.
B、某温度下,pH=6的NaCl溶液仍是中性溶液;
C、若2a mol?L-1HCN与a mol?L-1 NaOH溶液等体积混合后所得溶液是HCN和NaCN的混合液,溶液中c(Na+)>c(CN-),根据电荷守恒确定氢离子和氢氧根离子浓度的大小,判断酸碱性;
D、根据溶液中的电荷守恒来回答判断.
解答:
解:A、醋酸与醋酸钠的pH=7的混合溶液中c(OH-)=c(H+),根据电荷守恒得:c(CH3COO-)=c(Na+),故A正确;
B、某温度下,pH=6的NaCl溶液仍是中性溶液,c(Na+)=c(Cl-)>c(H+)=c(OH-),故B错误;
C、若2a mol?L-1HCN与a mol?L-1 NaOH溶液等体积混合后所得溶液是HCN和NaCN的混合液,溶液中c(Na+)>c(CN-),根据电荷守恒c(CN-)+c(OH-)=c(Na+)+c(H+),所以c(OH-)>c(H+),则混合溶液pH>7,故C正确;
D、0.1 mol NaHCO3和0.2molNa2CO3的混合液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故D正确.
故选B.
B、某温度下,pH=6的NaCl溶液仍是中性溶液,c(Na+)=c(Cl-)>c(H+)=c(OH-),故B错误;
C、若2a mol?L-1HCN与a mol?L-1 NaOH溶液等体积混合后所得溶液是HCN和NaCN的混合液,溶液中c(Na+)>c(CN-),根据电荷守恒c(CN-)+c(OH-)=c(Na+)+c(H+),所以c(OH-)>c(H+),则混合溶液pH>7,故C正确;
D、0.1 mol NaHCO3和0.2molNa2CO3的混合液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故D正确.
故选B.
点评:本题考查了离子浓度大小的比较,注意电荷守恒确定混合溶液酸碱性,根据电荷守恒来分析解答为易错点.

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案
相关题目
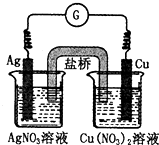 如图所示原电池的总反应为Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s),下列叙述正确的是( )
如图所示原电池的总反应为Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s),下列叙述正确的是( )| A、电子从银电极经导线流向铜电极 |
| B、工作一段时间后,右烧杯中溶液的pH变小 |
| C、电池工作时,Cu2+向铜电极移动 |
| D、将AgNO3溶液更换为Fe(NO3)3溶液,电流计指针反向偏转 |
向Na2CO3溶液中滴入2滴酚酞试液,溶液呈浅红色,微热后溶液的颜色将( )
| A、变深 | B、变浅 | C、不变 | D、褪去 |
下列叙述中正确的是( )
| A、牛油是纯净物,它不属于高分子 |
| B、牛油是一种高级脂肪酸 |
| C、牛油可以水解 |
| D、牛油比花生油要好,可以代替花生油使用 |
 如图为可逆反应:A(s)+D(g)?E(g);△H<0的逆反应速率随时间变化情况,试根据图中曲线判断下列说法中不正确的是( )
如图为可逆反应:A(s)+D(g)?E(g);△H<0的逆反应速率随时间变化情况,试根据图中曲线判断下列说法中不正确的是( )| A、t3时刻可能采取的措施是减小c(D) |
| B、t5时刻可能采取的措施是降温 |
| C、t7时刻可能采取的措施是减小压强 |
| D、t5~t6时间段平衡向逆反应方向移动 |
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示,下列叙述中正确的是( )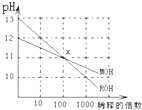

| A、MOH和ROH都是强碱 |
| B、在x点,c(M+)=c(R+) |
| C、稀释前,c(ROH)=10c(MOH) |
| D、常温下,pH之和为14的醋酸和ROH溶液等体积混合,所得溶液呈酸性 |
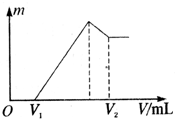 将0.1mol的镁、铝混合物溶于100mL 2mol?L-1的H2SO4溶液中,然后再滴1mol?L-1的NaOH溶液.请回答:(不需要写出计算过程)
将0.1mol的镁、铝混合物溶于100mL 2mol?L-1的H2SO4溶液中,然后再滴1mol?L-1的NaOH溶液.请回答:(不需要写出计算过程) 我国支持“人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是
我国支持“人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是