题目内容
目前市场上大量矿泉水、食用油等产品包装瓶几乎都是用PET(聚对苯二甲酸乙二醇酯,简称聚酯)制作的.利用废聚酯饮料瓶制备对苯二甲酸的流程及反应原理如下
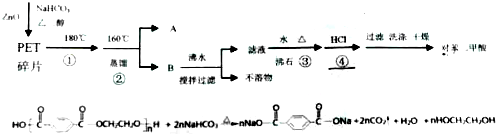
(1)步骤①反应过程中的现象是 .
(2)步骤②分离的物质A是 .
(3)步骤③加沸石的目的是 .
(4)步骤④用盐酸酸化的方程式是 .

(1)步骤①反应过程中的现象是
(2)步骤②分离的物质A是
(3)步骤③加沸石的目的是
(4)步骤④用盐酸酸化的方程式是
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:根据流程中提示的发生的反应知道:聚对苯二甲酸乙二醇酯在碱性环境下可以水解为对苯二甲酸钠溶液和乙二醇,利用蒸馏法可以分离二者,首先被蒸馏出来的是对乙二醇,剩余的溶液是对苯二甲酸钠溶液,向其中加入盐酸可以将其转化为对苯二甲酸,
(1)碳酸氢钠受热分解为碳酸钠和水以及二氧化碳,酯在碱性环境下水解为羧酸钠和醇类,据此结合已知反应来回答;
(2)对苯二甲酸钠溶液和乙二醇的混合物,利用蒸馏法可以分离二者;
(3)为防止溶液加热过程中的暴沸,可以加入碎石;
(4)对苯二甲酸钠溶液,向其中加入盐酸可以将其转化为对苯二甲酸,据此回答.
(1)碳酸氢钠受热分解为碳酸钠和水以及二氧化碳,酯在碱性环境下水解为羧酸钠和醇类,据此结合已知反应来回答;
(2)对苯二甲酸钠溶液和乙二醇的混合物,利用蒸馏法可以分离二者;
(3)为防止溶液加热过程中的暴沸,可以加入碎石;
(4)对苯二甲酸钠溶液,向其中加入盐酸可以将其转化为对苯二甲酸,据此回答.
解答:
解:根据流程中提示的发生的反应知道:聚对苯二甲酸乙二醇酯在碱性环境下可以水解为对苯二甲酸钠溶液和乙二醇,利用蒸馏法可以分离二者,首先被蒸馏出来的是对乙二醇,剩余的溶液是对苯二甲酸钠溶液,向其中加入盐酸可以将其转化为对苯二甲酸,
(1)聚对苯二甲酸乙二醇酯在碱性环境下水解为对苯二甲酸钠和乙二醇,根据给定的反应,现象是:固体溶解,有气泡产生;
故答案为:固体溶解,有气泡产生;
(2)对苯二甲酸钠溶液和乙二醇的混合物,利用蒸馏法可以分离二者,分离的物质A是乙二醇,故答案为:乙二醇;
(3)为防止溶液加热过程中的暴沸,可以加入碎石,故答案为:防止暴沸;
(4)对苯二甲酸钠溶液,向其中加入盐酸可以将其转化为对苯二甲酸,反应为: +2HCl→
+2HCl→ +2NaCl,故答案为:
+2NaCl,故答案为: +2HCl→
+2HCl→ +2NaCl.
+2NaCl.
(1)聚对苯二甲酸乙二醇酯在碱性环境下水解为对苯二甲酸钠和乙二醇,根据给定的反应,现象是:固体溶解,有气泡产生;
故答案为:固体溶解,有气泡产生;
(2)对苯二甲酸钠溶液和乙二醇的混合物,利用蒸馏法可以分离二者,分离的物质A是乙二醇,故答案为:乙二醇;
(3)为防止溶液加热过程中的暴沸,可以加入碎石,故答案为:防止暴沸;
(4)对苯二甲酸钠溶液,向其中加入盐酸可以将其转化为对苯二甲酸,反应为:
 +2HCl→
+2HCl→ +2NaCl,故答案为:
+2NaCl,故答案为: +2HCl→
+2HCl→ +2NaCl.
+2NaCl.
点评:本题考查是一道物质的分离和提纯的实验方案设计题,注意物质的性质是解题的关键,难度较大.

练习册系列答案
相关题目
下列关于Fe(OH)3胶体的制备,正确的操作是( )
| A、将FeCl3溶液滴入蒸馏水中即可 |
| B、将FeCl3溶液滴入热水中,得到黄色液体即可 |
| C、将FeCl3溶液滴入沸水中,得到红褐色液体即可 |
| D、将FeCl3溶液滴入沸水中,并继续加热煮沸至生成红褐色沉淀即可 |
下列有关实验的说法中错误的是( )
| A、在蒸馏的实验中,温度计的水银球位于支管口处是为了测出馏分的沸点 |
| B、可用四氯化碳萃取溴水中的溴 |
| C、在重结晶的实验中,使用短颈漏斗趁热过滤是为了减少被提纯物质的损失 |
| D、作为重结晶实验的溶剂,杂质在此溶剂中的溶解度受温度影响应该很大 |
 将0.1mol的镁、铝混合物溶于100mL 2mol?L-1的H2SO4溶液中,然后再滴1mol?L-1的NaOH溶液.请回答:(不需要写出计算过程)
将0.1mol的镁、铝混合物溶于100mL 2mol?L-1的H2SO4溶液中,然后再滴1mol?L-1的NaOH溶液.请回答:(不需要写出计算过程) 我国支持“人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是
我国支持“人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是