题目内容
现有前四周期T、X、Y、Z、W、M、N七种元素,已知W、Z、X、T、Y五种非金属元素原子半径依次减小,其中W原子的s电子总数等于p电子总数的2倍.M原子的M能层上有4个未成对电子,N+的最外层有18个电子.请完成下列问题:
(1)写出W、Z、X、T四种元素第一电离能由大到小的顺序(用元素符号表示) .
(2)W的基态原子轨道表示式为 ;Z的基态原子的简化电子排布式为 .
(3)N原子的基态电子排布式为 .
(4)M元素的+3价离子的电子排布式为 .
(5)YWX3-离子与M3+反应的离子方程式 .
(1)写出W、Z、X、T四种元素第一电离能由大到小的顺序(用元素符号表示)
(2)W的基态原子轨道表示式为
(3)N原子的基态电子排布式为
(4)M元素的+3价离子的电子排布式为
(5)YWX3-离子与M3+反应的离子方程式
考点:位置结构性质的相互关系应用
专题:
分析:根据W的s能级上电子总数等于p能级上电子总数的2倍,则电子排布式为:1s22s22p2,故为C,W、Z、X、T、Y五种非金属元素原子半径依次减小,则为同周期,故Z为N,X为O,T为F,Y为H,M原子的M能层上有4个未成对电子,则电子排布式为:1s22s22p63s23p63d64s2,故为Fe,N+的最外层有18个电子,则N为铜,据此解答各小题即可.
解答:
解:依据分析可知T为氟、X为氧、Y为氢、Z为氮、W为碳、M为铁、N为铜,
(1)C、N、O、F四种元素第一电离,非金属性越强,其第一电离能越大,但是由于N元素的p轨道处于半充满状态,故N的第一电离能大于O,故第一电离能由大到小的顺序为:F>N>O>C,故答案为:F>N>O>C;
(2)W为碳,C的基态原子轨道表示式为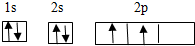 ,Z为N,N的基态原子的简化电子排布式为:[He]2s22p3,故答案为:
,Z为N,N的基态原子的简化电子排布式为:[He]2s22p3,故答案为: ;[He]2s22p3;
;[He]2s22p3;
(3)N为Cu,Cu原子的基态电子排布式为1s22s22p63s23p63d104s1,故答案为:[Ar]3d104s1;
(4)M为Fe,Fe元素的+3价离子的电子排布式为1s22s22p63s23p63d5,故答案为:1s22s22p63s23p63d5;
(5)YWX3-离子为HCO3-离子,与Fe3+发生双水解反应生成氢氧化铁沉淀和二氧化碳气体,反应的离子方程式为:3HCO3-+Fe3+=3CO2↑+Fe(OH)3↓,
故答案为:3HCO3-+Fe3+=3CO2↑+Fe(OH)3↓.
(1)C、N、O、F四种元素第一电离,非金属性越强,其第一电离能越大,但是由于N元素的p轨道处于半充满状态,故N的第一电离能大于O,故第一电离能由大到小的顺序为:F>N>O>C,故答案为:F>N>O>C;
(2)W为碳,C的基态原子轨道表示式为
 ,Z为N,N的基态原子的简化电子排布式为:[He]2s22p3,故答案为:
,Z为N,N的基态原子的简化电子排布式为:[He]2s22p3,故答案为: ;[He]2s22p3;
;[He]2s22p3;(3)N为Cu,Cu原子的基态电子排布式为1s22s22p63s23p63d104s1,故答案为:[Ar]3d104s1;
(4)M为Fe,Fe元素的+3价离子的电子排布式为1s22s22p63s23p63d5,故答案为:1s22s22p63s23p63d5;
(5)YWX3-离子为HCO3-离子,与Fe3+发生双水解反应生成氢氧化铁沉淀和二氧化碳气体,反应的离子方程式为:3HCO3-+Fe3+=3CO2↑+Fe(OH)3↓,
故答案为:3HCO3-+Fe3+=3CO2↑+Fe(OH)3↓.
点评:本题主要考查的是元素的推断以及元素化合物的知识,属于常考题.

练习册系列答案
相关题目
下列有关实验的说法中错误的是( )
| A、在蒸馏的实验中,温度计的水银球位于支管口处是为了测出馏分的沸点 |
| B、可用四氯化碳萃取溴水中的溴 |
| C、在重结晶的实验中,使用短颈漏斗趁热过滤是为了减少被提纯物质的损失 |
| D、作为重结晶实验的溶剂,杂质在此溶剂中的溶解度受温度影响应该很大 |
向Na2CO3溶液中滴入2滴酚酞试液,溶液呈浅红色,微热后溶液的颜色将( )
| A、变深 | B、变浅 | C、不变 | D、褪去 |
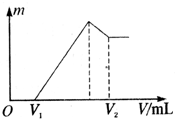 将0.1mol的镁、铝混合物溶于100mL 2mol?L-1的H2SO4溶液中,然后再滴1mol?L-1的NaOH溶液.请回答:(不需要写出计算过程)
将0.1mol的镁、铝混合物溶于100mL 2mol?L-1的H2SO4溶液中,然后再滴1mol?L-1的NaOH溶液.请回答:(不需要写出计算过程)