题目内容
3.下列关于元素周期表的叙述,错误的是( )| A. | 元素周期表揭示了化学元素间的内在联系,是化学发展史上重要里程碑 | |
| B. | 在周期表中,把电子层数相同的元素排成一横行,称为一周期 | |
| C. | 元素周期表中,总共有18个纵行,18个族,IIIB族含有32种金属元素 | |
| D. | 第IA族(除H)元素又称为碱金属元素,第ⅦA族元素又称为卤族元素 |
分析 A.元素周期表是元素周期律的具体表现形式;
B.原子结构中的电子层数等于元素在周期表中的周期数;
C.元素周期表中,总共有18个纵行,7个主族,7个副族,1个零族,1个ⅤⅢ族;
D.第IA族的元素中除H元素外都是碱金属,第VIIA族的元素都是非金属元素.
解答 解:A.元素周期表是元素周期律的具体表现形式,揭示了化学元素间的内在联系,是化学发展史上的重要里程碑之一,故A正确;
B.原子结构中的电子层数等于元素在周期表中的周期数,则电子层数相同的元素排成一横行,称为一周期,故B正确;
C.元素周期表中,总共有18个纵行,7个主族,7个副族,1个零族,1个ⅤⅢ族,共16个族,故C错误;
D.第IA族的元素中除H元素外都是碱金属,第IA族的元素又称为碱金属元素,第VIIA族的元素都是非金属元素,又称为卤族元素,故D正确;
故选C.
点评 本题考查原子周期表结构和元素周期律,明确元素周期表结构、元素周期律内涵是解本题关键,注意元素周期表中第VIII族含有3个纵行,为易错点.

练习册系列答案
相关题目
11.下列实验不能作为判断依据的是( )
| A. | 钠和镁分别与冷水反应,判断钠和镁金属性强弱 | |
| B. | 在MgCl2与AlCl3溶液中分别加入过量的NaOH溶液,判断镁与铝的金属性强弱 | |
| C. | 往硅酸钠溶液中通入CO2产生白色沉淀,判断碳酸与硅酸的酸性强弱 | |
| D. | 根据HF和HCl的水溶液的酸性强弱判断氟与氯的非金属性的强弱 |
8.a、b、c、d、e是同一周期的五种主族元素,a和b的最高价氧化物对应的水化物均呈碱性,且碱性b>a,c和d的气态氢化物的稳定性c>d;e是这五种元素中离子半径最小的元素,则它们的原子序数由小到大的顺序是( )
| A. | b、a、d、c、e | B. | e、b、a、d、c | C. | c、b、e、a、b | D. | b、a、e、d、c |
15.下列对物质的结构组成表示正确的是( )
| A. | 中子数为18的氯原子${\;}_{17}^{37}$Cl | B. | 硫离子的结构示意图 | ||
| C. | 过氧化钠的电子式 | D. | HClO的结构式H-O-Cl |
12.下列依据热化学方程式得出的结论正确的是( )
| A. | 若2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol,则H2燃烧热为241.8 kJ/mol | |
| B. | 若P4(白磷,s)=4P(红磷,s)△H=-29.2kJ/mol,则红磷比白磷稳定 | |
| C. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.4 kJ/mol,则20.0g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
13. 用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液,在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液,在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)该实验中,量取50mL盐酸或NaOH溶液,需要用到的玻璃仪器除胶头滴管外还要50ml量筒;
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是减少实验过程中的热量损失;
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指混合溶液的最高温度;
(4)计算该实验发生中和反应时放出的热量为1344J[中和后生成的溶液的比热容c=4.2J•(g•℃)-1,稀溶液的密度都为1g•cm-3];
(5)若用50mL 0.55mol•L-1的氨水(NH3•H2O)代替NaOH溶液进行上述实验,通过测得的反应热来计算中和热,测得的中和热△H会偏大(填“偏大”、“偏大”或“不变”),其原因是一水合氨为弱电解质,反应过程中电离需要吸收热量,故放出的热量偏少,△H偏大.
 用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液,在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液,在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:| 起始温度t1/℃ | 终止温度t2/℃ | 温度差 (t2-t1)/℃ | |||
| HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是减少实验过程中的热量损失;
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指混合溶液的最高温度;
(4)计算该实验发生中和反应时放出的热量为1344J[中和后生成的溶液的比热容c=4.2J•(g•℃)-1,稀溶液的密度都为1g•cm-3];
(5)若用50mL 0.55mol•L-1的氨水(NH3•H2O)代替NaOH溶液进行上述实验,通过测得的反应热来计算中和热,测得的中和热△H会偏大(填“偏大”、“偏大”或“不变”),其原因是一水合氨为弱电解质,反应过程中电离需要吸收热量,故放出的热量偏少,△H偏大.
 A、B、C、D是中学化学常见的四种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).
A、B、C、D是中学化学常见的四种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).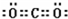 ;E的单质在空气中燃烧所生成物质的化学式SO2.
;E的单质在空气中燃烧所生成物质的化学式SO2.