题目内容
11.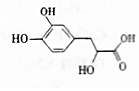 丹参素可用于祛瘀止痛、凉血消痈、养血安神.其结构简式如图.
丹参素可用于祛瘀止痛、凉血消痈、养血安神.其结构简式如图.(1)丹参素的分子式为C9H10O5,其所含官能团的名称为羟基、羧基.
(2)丹参素的核磁共振氢谱中有9组吸收峰.
(3)1mol丹参素最多消耗Br2的物质的量为3mol.
(4)1mol丹参素最多与2.5molNa2CO3溶液反应.
分析 由结构可知分子式,分子含酚-OH、醇-OH、-COOH,结合酚、醇、羧酸的性质来解答.
解答 解:(1)由结构可知丹参素的分子式为C9H10O5,其所含官能团的名称为酚羟基、醇羟基、羧基,故答案为:C9H10O5;羟基、羧基;
(2)分子中含9种H,丹参素的核磁共振氢谱中有9组吸收峰,故答案为:9;
(3)酚-OH的邻对位与溴水反应,1mol丹参素最多消耗Br2的物质的量为3mol,故答案为:3mol;
(4)酚-OH、-COOH均与碳酸钠反应,酚与碳酸钠以1:1反应,且2-COOH~Na2CO3,1mol丹参素最多与2.5molNa2CO3溶液反应,故答案为:2.5.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系是解本题关键,侧重分析与应用能力的考查,注意酚、羧酸的性质,题目难度不大.

练习册系列答案
相关题目
13.能用键能大小解释的事实是( )
| A. | 稀有气体化学性质很稳定 | B. | 硝酸易挥发,而硫酸难挥发 | ||
| C. | 氮气的化学性质比氧气稳定 | D. | 常温常压下,溴呈液态,碘呈固态 |
2.( )和下列离子方程式相对应的化学方程式正确的是.
| A. | Zn2++2OH-=Zn(OH)2↓ ZnCO3+2NaOH=Zn(OH)2↓+Na2CO3 | |
| B. | Ba2++SO42-=BaSO4↓ Ba(OH)2+H2SO4=BaSO4↓+2H2O | |
| C. | Ag++Cl-=AgCl↓ AgNO3+KCl=AgCl↓+KNO3 | |
| D. | Cu+2Ag+=Cu2++2Ag↓ Cu+2AgCl=2Ag+CuCl2 |
19.向某酸X的溶液中加人CaCO3固体.发生化学反应且生成CO2气体,下列叙述正确的是( )
| A. | CaCO3是弱电解质 | B. | CO2是弱电解质 | ||
| C. | 酸X一定是共价化合物 | D. | 酸X一定是强电解质 |
16.下列转化不能一步实现的是( )
| A. | Al→NaAlO2 | B. | Fe→Fe3O4 | C. | S→SO3 | D. | Si→SiO2 |
3.能与SO2气体发生反应,但无沉淀产生的是( )
①溴水②Ba(OH)2溶液③氢硫酸④Na2CO3⑤稀H2SO4⑥Na2SO3.
①溴水②Ba(OH)2溶液③氢硫酸④Na2CO3⑤稀H2SO4⑥Na2SO3.
| A. | 只有① | B. | ①③④ | C. | ④⑤⑥ | D. | ①④⑥ |
20.下列各组溶液中,不用其他试剂即能鉴别开的是( )
| A. | MgCl2和NaOH | B. | NaCl和AgNO3 | C. | NaHCO3和HCl | D. | AlCl3和KOH |
1.NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4L乙烯中含有的共用电子对数为6NA | |
| B. | 1L pH=13的氢氧化钡溶液中含有的OH-离子数为0.2NA | |
| C. | 46g的无水乙醇与足量乙酸在浓硫酸中加热,可生成88g乙酸乙酯 | |
| D. | 在反应KIO3+6HI═KI+3I2+3H2O中,若有1molH2O生成,则转移电子数为2NA |