题目内容
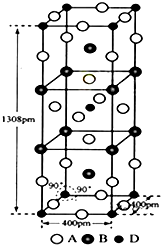
 若某金属单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.则晶胞中该原子的配位数为
若某金属单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.则晶胞中该原子的配位数为考点:不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:由晶胞结构可知,以顶点原子为研究对象,与之最近的原子处于面心上,每个顶点原子为12个面共用,该晶胞构型为面心立方,据此判断.
解答:
解:由晶胞结构图可知,以顶点原子为研究对象,与之最近的原子处于面心上,每个顶点原子为12个面共用,故晶胞中该原子的配位数为12,该单质晶体中原子的堆积方式为面心立方最密堆积;
故答案为:12;面心立方最密堆积.
故答案为:12;面心立方最密堆积.
点评:本题考查了晶胞结构图,题目难度不大,注意把握晶胞中该原子的配位数计算方法,熟悉常见的晶体堆积方式.

练习册系列答案
 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
 常温下,向100mL0.01mol/L的HA溶液中逐滴加入0.02mol/L的MOH溶液,图中所示曲线表示混合溶液的pH的变化情况,下列说法正确的是( )
常温下,向100mL0.01mol/L的HA溶液中逐滴加入0.02mol/L的MOH溶液,图中所示曲线表示混合溶液的pH的变化情况,下列说法正确的是( )| A、HA为弱酸 |
| B、在N到K间任意一点对应的溶液中:c(M+)+c(H+)═c(OH-)+c(A-) |
| C、K点对应的溶液中:c(M+)+c(MOH)═c(A-) |
| D、常温下,MA溶液的pH>7 |
下列过程中,需要降低化学反应速率的是( )
| A、制取氨气 | B、食物腐烂 |
| C、工业炼钢 | D、硫酸的生产 |
对于白磷引起的中毒,硫酸铜溶液是一种解毒剂,有关反应为:11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4.下列关于该反应的说法正确的是( )
| A、CuSO4发生了氧化反应 |
| B、氧化产物和还原产物的物质的量之比为5:6 |
| C、白磷只作还原剂 |
| D、该反应中被硫酸铜氧化的白磷有3mol |
下列说法或表示不正确的是( )
| A、氯乙烯可通过加聚反应生成高分子化合物 |
| B、CaC2,MgCl2,Na2O2中都含有共价键 |
| C、由水电离出的e(H+)=1.0*10-5mol?L-1的溶液中,可能含有Fe3+,NH4+,MnO4-,SO42- |
| D、若只已知某物质的实验式为C2H5,仍确定其化学式 |
已知:CaCO3(s)?CaO(s)+CO2(g)△H>0,△S>0,则该反应能自发进行的条件是( )
| A、低温 |
| B、高温 |
| C、任何温度下都能自发进行 |
| D、任何温度下都不能自发进行 |
下列关于物质的量浓度表述正确的是( )
| A、0.3mol?L-1Na2SO4溶液中含有Na+和SO42-总物质的量为0.9mol |
| B、当1L水吸收22.4L(标准状况)氨气时所得氨水的浓度是1mol?L-1 |
| C、在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量浓度相等,则K+和Cl-的物质的量浓度一定相同 |
| D、10℃的0.35mol?L-1的KCl饱和溶液100mL,蒸发掉5g水,冷却到10℃时过滤,其滤液中溶质的物质的量浓度仍为0.35mol?L-1 |
 前四周期元素A,B,C,D原子序数依次增大,A和B的价层电子只有一个单电子,且A-和B+的电子数相差8;C和D与B同周期,C和D的价层电子中未成对电子分别为4和2,且原子序数相差2.回答下列问题:
前四周期元素A,B,C,D原子序数依次增大,A和B的价层电子只有一个单电子,且A-和B+的电子数相差8;C和D与B同周期,C和D的价层电子中未成对电子分别为4和2,且原子序数相差2.回答下列问题: