题目内容
 常温下,向100mL0.01mol/L的HA溶液中逐滴加入0.02mol/L的MOH溶液,图中所示曲线表示混合溶液的pH的变化情况,下列说法正确的是( )
常温下,向100mL0.01mol/L的HA溶液中逐滴加入0.02mol/L的MOH溶液,图中所示曲线表示混合溶液的pH的变化情况,下列说法正确的是( )| A、HA为弱酸 |
| B、在N到K间任意一点对应的溶液中:c(M+)+c(H+)═c(OH-)+c(A-) |
| C、K点对应的溶液中:c(M+)+c(MOH)═c(A-) |
| D、常温下,MA溶液的pH>7 |
考点:中和滴定
专题:电离平衡与溶液的pH专题
分析:0.01mol?L-1 HA溶液中pH=2,则HA是强酸,N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱;
A.根据0.01mol/L的HA溶液的pH判断HA;
B.根据溶液中的成分,利用电荷守恒来分析;
C.根据溶液中的成分,利用物料守恒来分析;
D.根据MA是强酸弱碱盐来分析.
A.根据0.01mol/L的HA溶液的pH判断HA;
B.根据溶液中的成分,利用电荷守恒来分析;
C.根据溶液中的成分,利用物料守恒来分析;
D.根据MA是强酸弱碱盐来分析.
解答:
解:A.根据图象可知,0.01mol?L-1HA溶液中pH=2,则HA在溶液中完全电离,则HA为强酸,故A错误;
B.在N到K间任意一点对应的溶液中,溶液的成分为MA、MOH,根据电荷守恒有:c(OH-)+c(OH-)=c(H+)+c(M+),故B正确;
C.K点所示溶液中,l00mL 0.01mol/L HA的溶液中逐滴加入0.02mol/L MOH溶液100ml,反应后溶液中含有等浓度的MOH和MA溶液,所以c(M+)+c(MOH)≠c(A-),故C错误;
D.MA是强酸弱碱盐,MA溶液呈酸性,溶液pH<7,故D错误;
故选B.
B.在N到K间任意一点对应的溶液中,溶液的成分为MA、MOH,根据电荷守恒有:c(OH-)+c(OH-)=c(H+)+c(M+),故B正确;
C.K点所示溶液中,l00mL 0.01mol/L HA的溶液中逐滴加入0.02mol/L MOH溶液100ml,反应后溶液中含有等浓度的MOH和MA溶液,所以c(M+)+c(MOH)≠c(A-),故C错误;
D.MA是强酸弱碱盐,MA溶液呈酸性,溶液pH<7,故D错误;
故选B.
点评:本题考查了酸碱混合时的定性判断,注意根据酸溶液的pH和酸的浓度确定酸的强弱,为易错点.

练习册系列答案
相关题目
下列实验操作,现象或装置正确的是( )
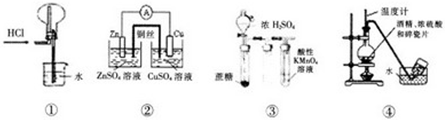

| A、实验①,氯化氢气体的吸收 |
| B、实验②,铜锌原电池 |
| C、实验③:酸性KMnO4溶液中出现气泡,且颜色不变 |
| D、实验④:实验室制取收集乙烯 |
压强对下列反应体系的反应速率影响不大的是( )
| A、N2+3H2?2NH3 |
| B、H2 (g)+I2 (g)?2HI(g) |
| C、2NO2?N2O4 |
| D、HCl+NaOH?NaCl+H2O |
在甲、乙、丙、丁4只集气瓶中分别装有Cl2、H2、HCl、HBr中的一种气体,纯净的丁点燃能够在甲中安静燃烧,甲、乙两瓶混合后,瓶壁上可见暗红色小液滴.则乙瓶中的气体是( )
| A、HBr |
| B、HCl |
| C、H2 |
| D、Cl2 |
下列说法正确的是( )
| A、铁在空气中燃烧可生成氧化铁,镁在空气中燃烧可生成氧化镁、氮化镁 |
| B、分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液和胶体之间 |
| C、红宝石、蓝宝石的主要成分是氧化铝,而石英玻璃、分子筛的主要成分是硅酸盐 |
| D、针对埃博拉病毒扩散情况,可选用含氯消毒剂对疫区可能的污染区域进行消毒预防 |

 若某金属单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.则晶胞中该原子的配位数为
若某金属单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.则晶胞中该原子的配位数为