��Ŀ����
3�����з�ӦCO��g��+H2O��g��?CO2��g��+H2��g����H��0����850��ʱ��K=1����1���������¶ȵ�950�棬�ﵽƽ��ʱKС�ڣ�����ڡ�����С�ڡ����ڡ���1��
��2��850��ʱ������һ�ݻ��ɱ���ܱ�������ͬʱ����1.0mol CO��3.0mol H2O��1.0mol CO2��x mol H2����
��x=5.0ʱ������ƽ�����淴Ӧ�������Ӧ�����淴Ӧ���������ƶ���
���� ��1�������¶�ƽ�������ȷ����ƶ����ݴ��ж�Kֵ�仯��
��2������Ũ���̺�ƽ�ⳣ���ȽϷ����ж�ƽ���ƶ�����
��� �⣺��1��CO��g��+H2O��g��?CO2��g��+H2��g����H��0������ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���ƽ�ⳣ����С�������������¶ȵ�950�棬�ﵽƽ��ʱKС��1��
�ʴ�Ϊ��С�ڣ�
����2��850��ʱ������һ�ݻ��ɱ���ܱ�������ͬʱ����1.0molCO��3.0molH2O��1.0molCO2��x mol H2���������ΪV����x=5.0ʱ��Qc=$\frac{\frac{5}{V}��\frac{1}{V}}{\frac{3}{V}��\frac{1}{V}}$=$\frac{5��1}{3��1}$=1.67��K=1��˵����ѧƽ��������У�
�ʴ�Ϊ���淴Ӧ��
���� ���⿼���˻�ѧƽ�ⳣ����Ӧ�ã���ȷƽ�ⳣ������ʽ�����壬��ϤӰ��ƽ�ⳣ����Ӱ�����ء�����Ũ������ƽ�ⳣ���жϷ�Ӧ���з���ķ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ
20�����ڷ�Ӧ3Br2+6NaOH�T5NaBr+NaBrO3+3H2O������������ȷ���ǣ�������
| A�� | Br2����������NaOH�ǻ�ԭ�� | |
| B�� | Br2�������������ǻ�ԭ�� | |
| C�� | ��������Brԭ�Ӻͱ���ԭ��Brԭ�ӵ����ʵ����ı�Ϊ5��1 | |
| D�� | ÿ����1mol��NaBrO3ת��10mol�ĵ��� |
1���������������ɳ�����չ������Υ�����ǣ�������
| A�� | ������ո�ͨ����ѧ��Ӧת��Ϊ�Ҵ���������ȼ�� | |
| B�� | �����з������л��ܼ����ˮ��Ϊ��ȡ�� | |
| C�� | ����CO2�ϳɾ�̼������ɽ������ϣ�ʵ�֡�̼����ѭ������ | |
| D�� | ʹ����Դ��Լ�͡������Ѻ��͵����オ�����ϰ�װ�� |
11����ͼΪ����ȼ�ϵ��ԭ��ʾ��ͼ�����մ�ͼ����ʾ��������������ȷ���ǣ�������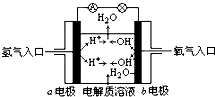

| A�� | b�缫�Ǹ��� | |
| B�� | �ܷ�Ӧ����ʽΪ��2H2+O2�T2H2O | |
| C�� | ����������ԭ��Ӧ����������������Ӧ | |
| D�� | ����ȼ�ϵ����һ�־��й㷺Ӧ��ǰ������ɫ��Դ |
8��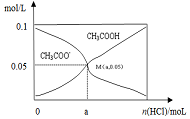 ��������10mL 0.1mol•L-1CH3COONa��Һ�У�����ͨ��HCl��CH3COO-��CH3COOHŨ�ȵı仯������ͼ��ʾ����������Һ����仯��������˵������ȷ���ǣ�������
��������10mL 0.1mol•L-1CH3COONa��Һ�У�����ͨ��HCl��CH3COO-��CH3COOHŨ�ȵı仯������ͼ��ʾ����������Һ����仯��������˵������ȷ���ǣ�������
 ��������10mL 0.1mol•L-1CH3COONa��Һ�У�����ͨ��HCl��CH3COO-��CH3COOHŨ�ȵı仯������ͼ��ʾ����������Һ����仯��������˵������ȷ���ǣ�������
��������10mL 0.1mol•L-1CH3COONa��Һ�У�����ͨ��HCl��CH3COO-��CH3COOHŨ�ȵı仯������ͼ��ʾ����������Һ����仯��������˵������ȷ���ǣ�������| A�� | M����Һ��ˮ�ĵ���̶ȱ�ԭ��ҺС | |
| B�� | ��M��ʱ��c��H+��-c��OH-��=��100a-5.0��10-2�� mol/L | |
| C�� | ����HCl��ͨ�룬$\frac{c��O{H}^{-}��}{c��C{H}_{2}CO{O}^{-}��}$ֵ���ϼ�С | |
| D�� | ��n��HCl��=1.0��10-3molʱ����Һ��c��Na+����c��Cl-����c��CHCOO-����c��H+����c��OH-�� |
15�� ijѧ����0.100mol•L-1��KOH����Һ�ζ�δ֪Ũ�ȵ����ᣬ������ɷ�Ϊ���¼�����
ijѧ����0.100mol•L-1��KOH����Һ�ζ�δ֪Ũ�ȵ����ᣬ������ɷ�Ϊ���¼�����
A����ȡ20.00mL����������Һע��ྻ����ƿ��������2��3�η�̪��
B���ñ���Һ��ϴ�ζ���2��3�Σ�
C����ʢ�б���Һ�ļ�ʽ�ζ��̶ܹ��ã����ڵζ���ʹ���촦������Һ��
D��ȡ��KOH��Һע���ʽ�ζ�����0�̶����� 2��3cm��
E������Һ����0��0���¿̶ȣ����¶�����
F������ƿ���ڵζ��ܵ����棬�ñ�KOH��Һ�ζ����յ㲢���µζ���Һ��Ŀ̶ȣ�
�ʹ�ʵ������������⣺
��1����ȷ���������˳����B��D��C��E��A��F������ĸ��ţ���
��2����ͼ���ų���ʽ�ζ��������ݵķ���Ӧ���ò���������ͼ��ţ������ἷѹ������ʹ���첿�ֳ�����Һ��
��3������B���������Ŀ���Ƿ�ֹ�ζ����ڱڸ��ŵ�ˮ������Һϡ�Ͷ�������
��4������A�������֮ǰ�������ô�����Һ��ϴ��ƿ����ζ����ƫ�ߣ��ƫ�ߡ�����ƫ�͡����䡱����
��5���жϵ���ζ��յ��ʵ�������ǵ������һ��KOH��Һ����Һ����ɫ��Ϊdz��ɫ�����ڰ�����ڲ���ɫ��
��6���ظ������ζ�2��3�Σ���¼���������
���ݱ������ݣ��ɼ�����������Ũ��ԼΪ0.09mol/L��������λС������
 ijѧ����0.100mol•L-1��KOH����Һ�ζ�δ֪Ũ�ȵ����ᣬ������ɷ�Ϊ���¼�����
ijѧ����0.100mol•L-1��KOH����Һ�ζ�δ֪Ũ�ȵ����ᣬ������ɷ�Ϊ���¼�����A����ȡ20.00mL����������Һע��ྻ����ƿ��������2��3�η�̪��
B���ñ���Һ��ϴ�ζ���2��3�Σ�
C����ʢ�б���Һ�ļ�ʽ�ζ��̶ܹ��ã����ڵζ���ʹ���촦������Һ��
D��ȡ��KOH��Һע���ʽ�ζ�����0�̶����� 2��3cm��
E������Һ����0��0���¿̶ȣ����¶�����
F������ƿ���ڵζ��ܵ����棬�ñ�KOH��Һ�ζ����յ㲢���µζ���Һ��Ŀ̶ȣ�
�ʹ�ʵ������������⣺
��1����ȷ���������˳����B��D��C��E��A��F������ĸ��ţ���
��2����ͼ���ų���ʽ�ζ��������ݵķ���Ӧ���ò���������ͼ��ţ������ἷѹ������ʹ���첿�ֳ�����Һ��
��3������B���������Ŀ���Ƿ�ֹ�ζ����ڱڸ��ŵ�ˮ������Һϡ�Ͷ�������
��4������A�������֮ǰ�������ô�����Һ��ϴ��ƿ����ζ����ƫ�ߣ��ƫ�ߡ�����ƫ�͡����䡱����
��5���жϵ���ζ��յ��ʵ�������ǵ������һ��KOH��Һ����Һ����ɫ��Ϊdz��ɫ�����ڰ�����ڲ���ɫ��
��6���ظ������ζ�2��3�Σ���¼���������
| ʵ�� ��� | KOH��Һ��Ũ�ȣ�mol•L-1�� | �ζ����ʱ������KOH��Һ�������mL�� | ����������Һ�������mL�� |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
12�����з�Ӧ�У�������������ԭ��Ӧ���ǣ�������
| A�� | H2+F2�T2HF | B�� | 3CO+Fe2O3$\frac{\underline{\;����\;}}{\;}$ 2Fe+3CO2 | ||
| C�� | NaOH+HCl�TNaCl+H2O | D�� | 4HNO3$\frac{\underline{\;\;��\;\;}}{\;}$ 2H2O+4NO2��+O2�� |
13��������һ����Դ��������Ҫ�ɷ���CH4��0.5molCH4��ȫȼ������CO2��Һ̬ˮʱ�ų�445kJ������������Ȼ�ѧ����ʽ����ȷ���ǣ�������
| A�� | CH4��g��+2O2��g���TCO2��g��+2H2O��l����H=-890kJ•mol-1 | |
| B�� | CH4��g��+2O2��g���TCO2��g��+2H2O��l����H=+890kJ•mol-1 | |
| C�� | CH4��g��+O2��g���TCO2��g��+H2O��l����H=-890kJ•mol-1 | |
| D�� | 2CH4��g��+4O2��g���T2CO2��g��+4H2O��g����H=+890kJ•mol-1 |