题目内容
13.离子方程式CO32-+2H+═CO2↑+H2O表示( )| A. | 碳酸盐与盐酸之间的反应 | B. | 一切碳酸盐与一切酸之间的反应 | ||
| C. | 可溶性碳酸盐与强酸之间的反应 | D. | 可溶性碳酸盐与一切酸之间的反应 |
分析 CO32-+2H+═CO2↑+H2O表示可溶性碳酸盐与强酸反应生成可溶性盐、水、二氧化碳的反应,以此来解答.
解答 解:CO32-+2H+═CO2↑+H2O表示可溶性碳酸盐与强酸反应生成可溶性盐、水、二氧化碳的反应,碳酸钡、碳酸钙、硫酸钡等不溶性盐在离子反应中保留化学式,则不能表示,
故选C.
点评 本题考查离子反应的意义,为高频考点,把握离子反应中保留化学式的物质及离子反应的意义为解答的关键,侧重分析与应用能力的考查,注意若生成硫酸钡在离子反应中保留化学式,题目难度不大.

练习册系列答案
相关题目
4.下列物质分类全部正确的是( )
①纯碱 ②食盐水 ③石灰水 ④NaHSO4 ⑤液态氧 ⑥NaOH.
①纯碱 ②食盐水 ③石灰水 ④NaHSO4 ⑤液态氧 ⑥NaOH.
| A. | 盐--①④ | B. | 碱--①⑥ | C. | 纯净物--③④⑤ | D. | 混合物--②⑤ |
1.下列叙述正确的是(NA为阿伏加德罗常数的值)( )
| A. | 7.8gNa2O2含有的共价键数为0.2NA | |
| B. | 7.8gNa2S与Na2O2的混合物,含离子总数为0.3NA | |
| C. | 标准状况下,22.4L溴单质含有NA个溴分子 | |
| D. | 0.2 molNa被完全氧化生成7.8gNa2O2,转移电子的数目为0.4NA |
8.在溶液导电性实验装置里,分别注入20mL 6mol•L-1醋酸和20mL 6mol•L-1氨水,灯光明暗程度相似,如果把这两种溶液混和后再试验则( )
| A. | 灯光明暗程度不变 | B. | 灯光变暗 | ||
| C. | 灯光明暗程度变化不明显 | D. | 灯光变亮 |
18.已知反应①101kPa时,2C(s)+O2(g)═2CO(g)△H=-221kJ/mol ②稀溶液中,H+(aq)+OHˉ(aq)═H2O(l);△H=-57.3kJ/mol下列结论正确的是( )
| A. | 碳的燃烧热大于110.5 kJ/mol | |
| B. | ①反应的焓变为-221 kJ/mol | |
| C. | 稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
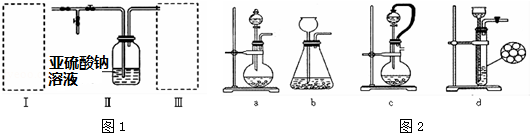
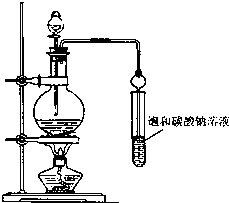 实验室合成乙酸乙酯粗产品的步骤如下:在蒸馏烧瓶内将过量的乙醇和少量浓H2SO4混合,然后经分液漏斗边滴加醋酸,边加热蒸馏,直接收集蒸馏产品可得到含有乙醇、乙醚、醋酸、少量水的乙酸乙酯粗产品.据此回答问题:
实验室合成乙酸乙酯粗产品的步骤如下:在蒸馏烧瓶内将过量的乙醇和少量浓H2SO4混合,然后经分液漏斗边滴加醋酸,边加热蒸馏,直接收集蒸馏产品可得到含有乙醇、乙醚、醋酸、少量水的乙酸乙酯粗产品.据此回答问题: CH3COOC2H5+H2O.
CH3COOC2H5+H2O.