题目内容
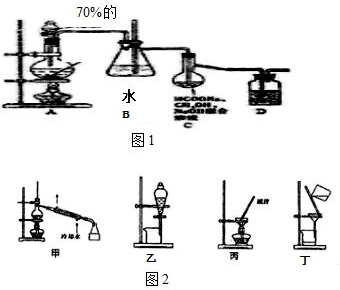
6. 乙酸正丁酯常用作香精,实验室用冰醋酸和正丁醇制备乙酸正丁酯
乙酸正丁酯常用作香精,实验室用冰醋酸和正丁醇制备乙酸正丁酯Ⅰ.乙酸正丁酯粗产品的制备
试管中加少许入沸石、7.4 mL正丁醇和6.4 mL冰醋酸,再加入3~4滴浓硫酸,然后安装好装置,加热使之反应.
Ⅱ.乙酸正丁酯粗产品的精制
将试管中的液体转移到分液漏斗中,用10 mL水洗涤,除去下层水层;有机层继续用10 mL 10% Na2CO3洗涤至中性;再用10 mL 的水洗涤.
将酯层进行蒸馏.蒸馏收集乙酸正丁酯产品时,应将温度控制在126.1℃左右.
Ⅲ.计算产率
称量出制得的乙酸正丁酯的质量为5.12 g.
已知:
| 物质 | 密度/g•cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 0.810 | 118.0 | 9 |
| 冰醋酸 | 1.049 | 118.1 | 互溶 |
| 乙酸正丁酯 | 0.882 | 126.1 | 0.7 |
(1)如图装置中长导管有冷凝回流作用,它可以由分水回流装置代替.分水回流装置中回流下来的蒸气冷凝液进入分水器,待分层后,有机层会自动流回到反应器中,将生成的水从分水器中放出去.
分水回流代替长导管回流,对乙酸正丁酯的合成有什么作用.可逆反应,水移离反应体系,平衡向生成酯的方向移动,产率提高
使用分水器装置进行回流的可逆反应反应,一般应具备条件.有水生成,回流有机物位于水上层(反应温度100℃左右)
(2)分水器在使用时须预先加水,使其水面低于分水器回流支管下沿3~5 mm的水.
预先加水的目的是.回流的有机物能及时返回反应体系
(3)反应时加热有利于提高酯的产率,但温度过高时酯的产率反而降低,其可能的原因是.乙酸、正丁醇大量挥发,发生副反应.
(4)水洗的目的是.除去水溶性杂质碱洗的目的是.除去酸性杂质测pH值的操作.pH试纸放在表而皿上,用蘸有待测溶液的玻璃棒点在试纸的中部,与比色卡对照读取pH值.
(5)本次实验乙酸正丁酯的产率.54.5%.
分析 (1)酯化反应是可逆反应,分离出生成物反应正向移动,有利于物质的生成;分水器需要反应由水生成,水在下层可从分水器下口放出,达到分离出水的作用;
(2)有机层要自动回流到反应器,分水器中预先加水,有机层较早到达分水器的支管口出,回到反应体系继续反应;
(3)温度过高乙酸乙醇挥发,反应物减少,温度过高也会有副反应发生;
(4)乙酸正丁酯中混有少量的乙醇与乙酸,正丁醇乙酸易溶于水,水洗,乙酸又显酸性,碱洗,测PH的操作为pH试纸放在表而皿上,用蘸有待测溶液的玻璃棒点在试纸的中部,与比色卡对照读取pH值;
(5)从题中的数据计算乙酸正丁酯的理论产量,计算产率.
解答 解:(1)酯化反应为可逆反应,分离出生成物水可使反应正向移动,有利于乙酸正丁酯的生成;分水器作用是分离水与其他有机物,故产物中要求有水生成,水从分水器下端放出,有机层从支管处回到反应容器,所以要求有机层在上层,
故答案为:可逆反应,水移离反应体系,平衡向生成酯的方向移动,产率提高;有水生成,回流有机物位于水上层(反应温度100℃左右);
(2)分水器下层分离出水,上层有机层从支管回到反应体系,分水器预先加水,可使蒸发出的有机物快速到达支管处,回到容器继续反应,
故答案为:回流的有机物能及时返回反应体系;
(3)由题图表信息,乙酸与正丁醇高温易挥发,反应物减少,不利于乙酸正丁酯的生成,另温度过高时,正丁醇可发生取代反应生成醚或消去反应生成烯,
故答案为:乙酸、正丁醇大量挥发,发生副反应;
(4)由图表可知正丁醇乙酸溶于水,用水洗去水溶性的杂质,乙酸又为酸,可用碱液除去.测PH的操作为:pH试纸放在表而皿上,用蘸有待测溶液的玻璃棒点在试纸的中部,与比色卡对照读取pH值,
故答案为:除去水溶性杂质;除去酸性杂质; pH试纸放在表而皿上,用蘸有待测溶液的玻璃棒点在试纸的中部,与比色卡对照读取pH值;
(5)由反应可知n(正丁醇):n(冰醋酸):n(乙酸正丁酯)=1:1:1,加入的n(正丁醇)=7.4ml×0.810g/ml÷74g/mol=0.081mol,n(乙酸)=6.4ml×1.049g/ml÷60g/mol=0.1mol,n(正丁醇):n(乙酸)=0.081:0.1<1:1,所以乙酸过量,正丁醇反应完全,由正丁醇可知理论上生成的乙酸正丁酯也为0.081mol,故乙酸正丁酯的理论质量为0.081mol×116g/mol=9.396g,所以产率为5.12÷9.396×100%≈54.4%,
故答案为:54.5%
点评 本题考查了酯化反应实验产物的分离提纯,产率的计算,其中结合了化学原理中的平衡移动,较为灵活.

①纯碱 ②食盐水 ③石灰水 ④NaHSO4 ⑤液态氧 ⑥NaOH.
| A. | 盐--①④ | B. | 碱--①⑥ | C. | 纯净物--③④⑤ | D. | 混合物--②⑤ |
| A. | Al3+ | B. | Ba2+ | C. | Cl- | D. | Mg2+ |
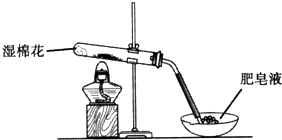 某探究小组采用如图所示装置进行Fe粉与水蒸气的反应.
某探究小组采用如图所示装置进行Fe粉与水蒸气的反应.(1)实验前检查装置气密性的方法为将导气管末端浸入水槽中,加热A处圆底烧瓶,导管末端出现气泡,停止加热后导管末端出现一段水柱.
(2)检验实验中生成气体的实验操作是点燃气体,在火焰上方罩干冷烧杯,观察烧杯内壁出现液滴,证明生成了H2.
(3)将探究小组分为两组,按题图装置进行对比实验,甲组用酒精喷灯、乙组用酒精灯加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验.
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,无气泡 |
| 2 | 取步骤1中溶液,滴加酸性KMnO4溶液 | 紫色褪去 | 紫色褪去 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
②甲组步骤1中反应的离子方程式为Fe3O4+8H+=Fe2++2Fe3++4H2O.
③乙组步骤4中,溶液变红的原因为Fe2+被氧化为Fe3+;溶液褪色可能的原因是可能是Cl2将SCN-氧化;验证方法为再继续加入KSCN溶液则溶液变红.
 可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空:
可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空: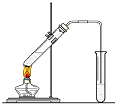 在实验室我们用如图所示的装置制取乙酸乙酯.回答下列问题:
在实验室我们用如图所示的装置制取乙酸乙酯.回答下列问题: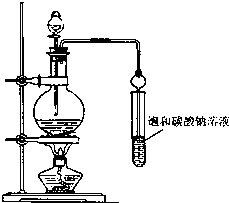 实验室合成乙酸乙酯粗产品的步骤如下:在蒸馏烧瓶内将过量的乙醇和少量浓H2SO4混合,然后经分液漏斗边滴加醋酸,边加热蒸馏,直接收集蒸馏产品可得到含有乙醇、乙醚、醋酸、少量水的乙酸乙酯粗产品.据此回答问题:
实验室合成乙酸乙酯粗产品的步骤如下:在蒸馏烧瓶内将过量的乙醇和少量浓H2SO4混合,然后经分液漏斗边滴加醋酸,边加热蒸馏,直接收集蒸馏产品可得到含有乙醇、乙醚、醋酸、少量水的乙酸乙酯粗产品.据此回答问题: CH3COOC2H5+H2O.
CH3COOC2H5+H2O.