题目内容
11. Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.Ⅰ.制备Na2S2O3•5H2O
反应原理:Na2SO3 (aq)+S(s)$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3 (aq)
实验步骤:
①称取15g Na2SO3加入圆底烧瓶中,再加入80mL蒸馏水. 另取5g研细的硫粉,用3mL乙醇润湿,加入上述溶液中.
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60分钟.
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3•5H2O,经过滤、洗涤、低温干燥,得到产品.
回答问题:
(1)Na2S2O3 中硫元素的化合价为+2;Na2S2O3在强酸性溶液中不能稳定存在,其原因为S2O32-+2H+=S↓+SO2↑+2H2O(用离子方程式表示).
(2)仪器a的名称是冷凝管,其作用是冷凝回流乙醇
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是Na2SO4. 检验其是否存在的方法是取少量产品溶于过量稀盐酸,过滤,向滤液中滴加BaCl2溶液,若产生白色沉淀说明产品中含有Na2SO4.
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0mol•L-1碘的标准溶液滴定(反应原理为:2S2O32-+I2═S4O62-+2I-).
(4)滴定至终点时,溶液颜色的变化:由无色变蓝色,半分钟内不褪色.
(5)滴定结束后消耗碘的标准溶液体积为20.00mL.产品的纯度为(用含W的代数式表示)$\frac{0.992}{W}×100%$.
分析 Ⅰ(1)根据化合物中化合价代数和为0计算;Na2S2O3在强酸性溶液中生成硫单质和二氧化硫;
(2)根据仪器构造和作用可得;
(3)由于S2O32?具有还原性,易被氧气氧化成硫酸根离子可知杂质为硫酸钠;根据检验硫酸根离子的方法检验杂质硫酸钠;
Ⅱ(4)滴定前溶液为无色,滴定结束后,碘单质使淀粉变蓝;
(5)依据化学反应方程式2S2O32-+I2═S4O42-+2I-计算.
解答 解:I (1)Na2S2O3 中钠元素化合价为+1加,氧元素化合价为-2价,化合物中化合价代数和为0,则硫元素的化合价为+2价;Na2S2O3在强酸性溶液中生成硫单质和二氧化硫,发生的反应为:S2O32-+2H+=S↓+SO2↑+2H2O;
故答案为:+2;S2O32-+2H+=S↓+SO2↑+2H2O;
(2)仪器a为:冷凝管,作用是冷凝回流乙醇;
故答案为:冷凝管;冷凝回流乙醇;
(3 )S2O32?具有还原性,能够被氧气氧化成硫酸根离子,所以可能存在的杂质是硫酸钠;检验硫酸钠的方法为:取少量产品溶于过量稀盐酸,过滤,向滤液中加BaCl2溶液,若有白色沉淀,则产品中含有Na2SO4;
故答案为:Na2SO4;取少量产品溶于过量稀盐酸,过滤,向滤液中滴加BaCl2溶液,若产生白色沉淀说明产品中含有Na2SO4;
II (4)滴定结束后,碘单质使淀粉变蓝,所以滴定终点时溶液颜色变化为:由无色变为蓝色,且半分钟内部褪色;
故答案为:由无色变蓝色,半分钟内不褪色;
(5)2S2O32-+I2═S4O62-+2I-,
2 1
x 0.100 0mol•L-1×20×10-3mL
解x=0.002mol,故Na2S2O3•5H2O的物质的量为0.002mol,质量为:0.002×248g/mol=0.992g,则W g产品的纯度为:$\frac{0.992}{W}×100%$;
故答案为:$\frac{0.992}{W}×100%$.
点评 本题考查化学实验制备,涉及仪器识别、离子的检验方法、氧化还原反应滴定与计算、离子方程式书写等,是对学生综合能力的考查,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | -定条件下在密闭容器中2molSO2与2molO2充分反应,最终的气体分子数为3NA | |
| C. | 将1molNH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| D. | 4.6g乙醇含有共价键的数目为0.9NA |
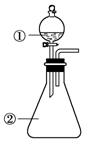 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| D | 饱和氯化铁溶液 | 浓氢氧化钠溶液 | 溶液呈红褐色 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 甲烷分子的比例模型为  ,其二氯取代物有2种结构 ,其二氯取代物有2种结构 | |
| B. | 苯和乙烯都能使溴水褪色,其褪色原理相同 | |
| C. | 相同质量的乙炔与苯分别在足量的氧气中完全燃烧,消耗氧气的物质的量相同 | |
| D. | 在一定条件下,苯与氯气生成氯苯的反应类型是加成反应 |
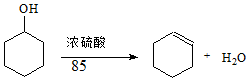
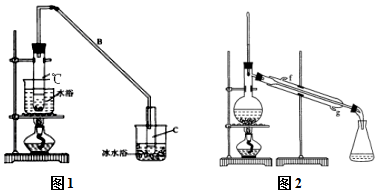 某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯
某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯已知:
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
①A中碎瓷片的作用是防暴沸,导管B除了导气外还具有的作用是冷凝.
②试管C置于冰水浴中的目的是防止环己烯挥发或冷凝环己烯.
(2)制备精品:
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上 层(填上或下),分液后,用CD(填编号)洗涤环己烯.
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液 D.NaOH溶液
②再将环己烯按图2装置蒸馏,冷却水从g(填f或g)口进入,蒸馏时要加入生石灰,目的是除水.
③收集产品时,控制的温度应在83℃ 左右,实验制得的环己烯精品质量低于理论产量,可能的原因是C.
A.蒸馏时从70℃开始收集产品 B.环己醇实际用量多了 C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,最简单的方法是BC.
A.酸性KMnO4溶液 B.用金属钠 C.测定沸点 D.溴的四氯化碳溶液.

 ;分子M发生加聚反应产物的结构简式
;分子M发生加聚反应产物的结构简式 .
.
 氢氧化镍在乙醇的悬浊液中可发生如下反应生成单质镍的配合物:Ni(OH)2+5CH3NC═(CH3NC)4Ni+CH3NCO+H2O
氢氧化镍在乙醇的悬浊液中可发生如下反应生成单质镍的配合物:Ni(OH)2+5CH3NC═(CH3NC)4Ni+CH3NCO+H2O