题目内容
17.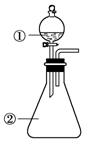 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| D | 饱和氯化铁溶液 | 浓氢氧化钠溶液 | 溶液呈红褐色 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.盐酸先与NaOH反应;
B.Al遇浓硝酸发生钝化;
C.草酸与高锰酸钾发生氧化还原反应;
D.氯化铁与NaOH溶液发生复分解反应生成沉淀.
解答 解:A.盐酸先与NaOH反应,则不能立即生成气体,故A错误;
B.Al遇浓硝酸发生钝化,生成致密的氧化膜阻止反应的发生,则不能产生红棕色气体,故B错误;
C.草酸与高锰酸钾发生氧化还原反应,则溶液逐渐褪色,故C正确;
D.氯化铁与NaOH溶液发生复分解反应生成红褐色沉淀,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应与现象、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.

练习册系列答案
 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
7. 锌-空气电池(原理如图)适宜用作城市电动车的动力电源.该电池放电时Zn转化为ZnO.该电池工作时下列说法正确的是( )
锌-空气电池(原理如图)适宜用作城市电动车的动力电源.该电池放电时Zn转化为ZnO.该电池工作时下列说法正确的是( )
 锌-空气电池(原理如图)适宜用作城市电动车的动力电源.该电池放电时Zn转化为ZnO.该电池工作时下列说法正确的是( )
锌-空气电池(原理如图)适宜用作城市电动车的动力电源.该电池放电时Zn转化为ZnO.该电池工作时下列说法正确的是( )| A. | 氧气在石墨电极上发生氧化反应 | |
| B. | 该电池的负极反应为Zn+H2O-2e-=ZnO+2H+ | |
| C. | 该电池放电时OH-向石墨电极移动 | |
| D. | 该电池充电时应将Zn电极与电源负极相连 |
5.下列各组离子中,在酸性溶液中能大量共存,且溶液为无色透明的是( )
| A. | K +、.MnO 4 -、Cl -、SO 4 2- | B. | Na +、CO 3 2-、Cl -、SO 4 2- | ||
| C. | NO 3 -、Na +、HCO 3 -、Ba 2+ | D. | Na +、NO 3 -、NH 4 +、SO 4 2- |
12.下列解释事实的方程式正确的是( )
| A. | 向稀HNO3中加入铜粉产生气体:Cu+4H++2NO3-═Cu2++2NO2↑+H2O | |
| B. | 向H2SO4溶液中加入Ba(OH)2产生沉淀:SO42-+Ba2+═BaSO4↓ | |
| C. | 向Ca(ClO)2溶液中通入过量CO2制取HClO:2ClO-+H2O+CO2═HClO+CO32- | |
| D. | 向水中加入金属钠产生气体:2Na+2H2O═2Na++2OH-+H2↑ |
9.在四支试管中分别加入少量不同的无色无味溶液进行如下操作,结论正确的是( )
| 操作 | 现象 | 结论 | |
| A | 先加硝酸,再滴加BaCl2溶液 | 产生白色沉淀 | 原溶液中一定有SO42- |
| B | 先加入H2O2溶液,再加KSCN溶液 | 溶液呈血红色 | 原溶液中一定有Fe2+ |
| C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中一定有Na+、无K+ |
| D | 滴加NaOH溶液,加热,将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 原溶液中一定有NH4+ |
| A. | A | B. | B | C. | C | D. | D |
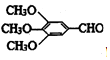 )和抗癫痫药物H(
)和抗癫痫药物H(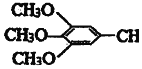 =CHCONHCH(CH3)2)的路线如图(部分反应略去条件和试剂):
=CHCONHCH(CH3)2)的路线如图(部分反应略去条件和试剂):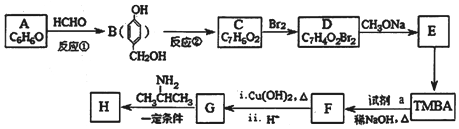
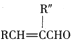 (R、R″表示烃基或氢)
(R、R″表示烃基或氢)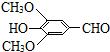 ,试剂a的分子式是C2H4O.
,试剂a的分子式是C2H4O.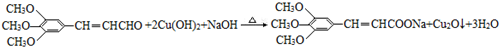 .
.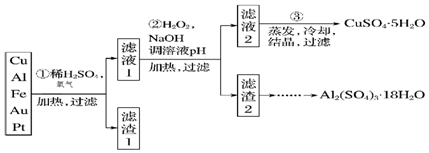
 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.