题目内容
6.下列说法正确的是( )| A. | 甲烷分子的比例模型为  ,其二氯取代物有2种结构 ,其二氯取代物有2种结构 | |
| B. | 苯和乙烯都能使溴水褪色,其褪色原理相同 | |
| C. | 相同质量的乙炔与苯分别在足量的氧气中完全燃烧,消耗氧气的物质的量相同 | |
| D. | 在一定条件下,苯与氯气生成氯苯的反应类型是加成反应 |
分析 A.甲烷为正四面体结构,只有一种H;
B.苯与溴水不反应,乙烯与溴水发生加成反应;
C.乙炔与苯的最简式相同,均为CH,含C、H的质量分数相同;
D.苯与氯气生成氯苯,苯环上H被Cl取代.
解答 解:A.甲烷为正四面体结构,只有一种H,则比例模型为  ,其二氯取代物有1种结构,故A错误;
,其二氯取代物有1种结构,故A错误;
B.苯与溴水不反应,乙烯与溴水发生加成反应,则褪色原理不痛,前者为萃取、后者为化学反应,故B错误;
C.乙炔与苯的最简式相同,均为CH,含C、H的质量分数相同,则相同质量的乙炔与苯分别在足量的氧气中完全燃烧,消耗氧气的物质的量相同,故C正确;
D.苯与氯气生成氯苯,苯环上H被Cl取代,为取代反应,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高考常见题型和高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意选项A为易错点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列说法正确的是( )
| A. | 铅蓄电池在充电过程中,正、负极质量都增大 | |
| B. | 标准状况下,22.4 L CCl4和CH2O的混合物中含有6.02×1023个碳原子 | |
| C. | 0.1 mol•L-1 CH3COOH溶液加水稀释,溶液中的离子浓度均减小 | |
| D. | 将CH3COONa溶液从20℃升温至30℃,溶液中醋酸根离子浓度减小 |
15.在无色透明的溶液中,能大量共存的离子组是( )
| A. | K+、Cu2+、SO42-、Cl- | B. | Na+、H+、Cl-、CO32- | ||
| C. | H+、Ba2+、Cl-、NO3- | D. | K+、Fe2+、OH-、NO3- |
12.下列解释事实的方程式正确的是( )
| A. | 向稀HNO3中加入铜粉产生气体:Cu+4H++2NO3-═Cu2++2NO2↑+H2O | |
| B. | 向H2SO4溶液中加入Ba(OH)2产生沉淀:SO42-+Ba2+═BaSO4↓ | |
| C. | 向Ca(ClO)2溶液中通入过量CO2制取HClO:2ClO-+H2O+CO2═HClO+CO32- | |
| D. | 向水中加入金属钠产生气体:2Na+2H2O═2Na++2OH-+H2↑ |
16.下列有关有机化合物的说法正确的是( )
| A. | CH2=CHCH3分子中所有原子在一个平面上 | |
| B. | 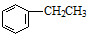 的同分异构体中,苯环上的一氯代物只有一种的结构有4种 的同分异构体中,苯环上的一氯代物只有一种的结构有4种 | |
| C. | CH2=CHCH2OH能发生加成发应、取代反应、氧化反应等 | |
| D. | 苯乙烯(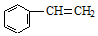 )能使溴水褪色,1mol苯乙烯与溴水反应时最多消耗4mol Br2 )能使溴水褪色,1mol苯乙烯与溴水反应时最多消耗4mol Br2 |
 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.


