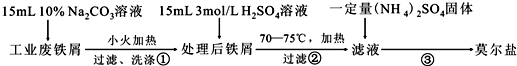
题目内容
15.为了研究碳酸钙与盐酸反应的反应速率,某同学通过图1实验装置测定反应中生成的CO2气体体积,并绘制出图2所示的曲线,在该实验过程中发现锥形瓶温度明显升高.请分析、讨论并回答以下问题: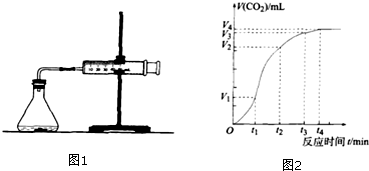
(1在O~t1、t1~t2、t2~t3各相同的时间段里,反应速率最大的时间段是t1~t2;可能的原因是该反应为放热反应,反应一段时间后,溶液的温度升高,使得反应速率加快.
(2为减缓上述反应速率,欲向盐酸溶液中加入下列物质,你认为可行的有AC.
A.蒸馏水 B.NaCl固体 C.NaCl溶液 D.通入HCl
(3)在t4后,收集到的气体的体积不再增加,可能的原因是反应物中有一种已经消耗完.
分析 (1)根据图象知,曲线的斜率为该反应的化学反应速率,斜率越大其反应速率越大;温度越高,反应速率越快;收集到的气体最多的是体积之差最大的;
(2)降低反应速率,可以通过减小溶液中氢离子浓度实现;
(3)在t4后,气体体积不再增加,说明反应物中有一种已经消耗完.
解答 解(1)曲线的斜率为该反应的化学反应速率,斜率越大其反应速率越大,根据图象知,斜率最大的是t1~t2,反应的化学反应速率最快,该反应是放热反应,放出的热量使溶液温度升高,升高温度,反应速率加快,
故答案为:t1~t2;该反应为放热反应,反应一段时间后,溶液的温度升高,使得反应速率加快;
(2)降低反应速率,可以通过减小溶液中氢离子浓度实现,加水稀释或加入氯化钠溶液都能使氢离子浓度降低,从而降低反应速率,通入氯化氢使溶液中氢离子浓度增大,反应速率加快,
故答案为:AC;
(3)该反应为不可逆反应,在t4后,收集到的气体体积不再增加,说明反应物中有一种已经消耗完,故答案为:反应物中有一种已经消耗完.
点评 本题考查了化学反应速率的影响因素,为高频考点,侧重于学生的分析能力的考查,注意把握浓度、温度对化学反应速率影响,把握图象斜率与速率的关系,题目难度不大.

练习册系列答案
相关题目
5.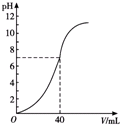 用1mol•L-1NaOH溶液中和某浓度的硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示,原硫酸溶液的物质的量浓度和反应后溶液的总体积(体积变化忽略不计)分别是( )
用1mol•L-1NaOH溶液中和某浓度的硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示,原硫酸溶液的物质的量浓度和反应后溶液的总体积(体积变化忽略不计)分别是( )
 用1mol•L-1NaOH溶液中和某浓度的硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示,原硫酸溶液的物质的量浓度和反应后溶液的总体积(体积变化忽略不计)分别是( )
用1mol•L-1NaOH溶液中和某浓度的硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示,原硫酸溶液的物质的量浓度和反应后溶液的总体积(体积变化忽略不计)分别是( )| A. | 0.5 mol•L-1 100 mL | B. | 0.5 mol•L-180 mL | ||
| C. | 1 mol•L-160 mL | D. | 1 mol•L-180 mL |
7.下列说法正确的是( )
| A. | 石蜡油分解产生的气态产物中不含有不饱和烃 | |
| B. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 | |
| C. | 油脂是种高级脂肪酸甘油酯,其中植物油通过氢化可以变成脂肪 | |
| D. | 苯与浓硝酸、浓硫酸混合,加强热以制备硝基苯 |
5.短周期主族元素X、Y、Z、W的原子序数依次增大.X、Y、Z、W原子的最外层电子数之和为18,X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构.下列说法正确的是( )
| A. | Y分别与Z、W形成的化合物中化学键类型不相同 | |
| B. | 单质的沸点:Y>Z | |
| C. | X、Y、Z三种元素不可能形成离子化合物 | |
| D. | X的最高价氧化物对应的水化物的酸性比W的强 |
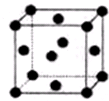 X、Y、Z、W、R.均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,Y原子最外层有2对成对电子,Z的原子序数为Y的原子序数的2倍,W3+的基态离子3d轨道为半充满状态,R的氢氧化物悬浊液可用于检验葡萄糖的存在.
X、Y、Z、W、R.均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,Y原子最外层有2对成对电子,Z的原子序数为Y的原子序数的2倍,W3+的基态离子3d轨道为半充满状态,R的氢氧化物悬浊液可用于检验葡萄糖的存在.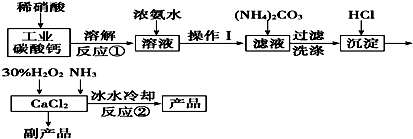
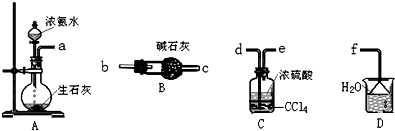
 案.
案.