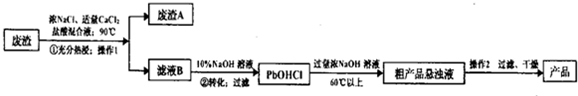
题目内容
8.已知在浓H2SO4存在并加热至170℃的过程中,2个乙醇分子在羟基上可发生分子间脱水反应生成醚,如CH3CH2-OH+HO-CH2CH3$→_{140℃}^{浓H_{2}SO_{4}}$CH3CH2-O-CH2CH3+H2O.用浓H2SO4跟分子式分别为CH4O和C3H8O的醇的混合液在一定条件下反应,可得到的有机物的种类有( )
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
分析 用浓硫酸与分子式分别为CH4O和C3H8O的醇的混合液反应,将乙醇和浓硫酸反应的温度控制在140℃,甲醇与甲醇分子间脱水,丙醇分子之间脱水,丙醇与甲醇分子之间脱水,分析两种醇的结构,结合反应原理利用组合计算判断;
解答 解:CH4O醇结构为:CH3OH,C3H8O的醇结构简式为:CH3CH2CH2OH、CH3CH(CH3)OH,
甲醇与甲醇分子之间脱水有1种,丙醇分子之间脱水有1+1+1=3种,甲醇与丙醇分子之间脱水有1×2=2种,
故可以形成的醚有1+3+2=6种,
故选B.
点评 本题考查了分子结构的分析、同分异构体的应用书写,理解分子间的脱水反应实质是解题关键,题目较简单.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
7.下列说法正确的是( )
| A. | 石蜡油分解产生的气态产物中不含有不饱和烃 | |
| B. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 | |
| C. | 油脂是种高级脂肪酸甘油酯,其中植物油通过氢化可以变成脂肪 | |
| D. | 苯与浓硝酸、浓硫酸混合,加强热以制备硝基苯 |
8.下列说法不正确的是( )
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口下沿处 | |
| C. | 蒸发结晶时应将溶液蒸干 | |
| D. | 能用CCl4从碘水中萃取碘是由于CCl4与H2O互不相溶且碘在CCl4中溶解度比在水中的大 |
5.短周期主族元素X、Y、Z、W的原子序数依次增大.X、Y、Z、W原子的最外层电子数之和为18,X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构.下列说法正确的是( )
| A. | Y分别与Z、W形成的化合物中化学键类型不相同 | |
| B. | 单质的沸点:Y>Z | |
| C. | X、Y、Z三种元素不可能形成离子化合物 | |
| D. | X的最高价氧化物对应的水化物的酸性比W的强 |
3. 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂刚好变色,且并不马上变色为止,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.试回答下列问题:
(1)滴定终点的现象:当滴入最后一滴盐酸时,锥形瓶中的溶液从红色变为无色,且半分钟内不变色
(2)滴定时边滴边摇动锥形瓶,眼睛应观察B
A、滴定管内液面的变化 B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是用待测溶液润洗锥形瓶由此造成的测定结果偏高(偏高、偏低或无影响)
(4)步骤②缺少的操作是酸式滴定管用蒸馏水洗净后,应用标准液润洗
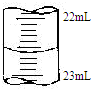
(5)如图是某次滴定时的滴定管中的液面,其读数为22.60mL
(6)根据下列数据:
请计算待测烧碱溶液的浓度(保留四位小数)0.0800mol/L.
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂刚好变色,且并不马上变色为止,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.试回答下列问题:
(1)滴定终点的现象:当滴入最后一滴盐酸时,锥形瓶中的溶液从红色变为无色,且半分钟内不变色
(2)滴定时边滴边摇动锥形瓶,眼睛应观察B
A、滴定管内液面的变化 B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是用待测溶液润洗锥形瓶由此造成的测定结果偏高(偏高、偏低或无影响)
(4)步骤②缺少的操作是酸式滴定管用蒸馏水洗净后,应用标准液润洗
(5)如图是某次滴定时的滴定管中的液面,其读数为22.60mL
(6)根据下列数据:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
13.下列实验事实或结论正确的是( )
| A. | 二氧化硫气体通入硝酸钡溶液,生成白色BaSO4沉淀 | |
| B. | 氨气的水溶液可以导电,所以氨气是电解质 | |
| C. | 酸性高锰酸钾溶液中通入二氧化硫气体,溶液褪色,证明二氧化硫有漂白性 | |
| D. | 硝酸具有挥发性,所以硝酸不稳定 |
20.下列叙述正确的是( )
| A. | Fe 与S混合加热生成FeS | |
| B. | Fe与Cl2反应生成FeCl2 | |
| C. | 过量的铜与浓硝酸反应有一氧化氮生成 | |
| D. | 氯气具有漂白性 |
17.有机物M可从酸牛奶中提取.已知纯净的M为无色黏稠液体,易溶于水.为研究M的组成与结构,进行了如下实验:
| 实验步骤 | 解释或实验结论 |
| (1)称取M 4.5g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空:(1)M的摩尔质量为:90g/mol. |
| (2)将此4.5g M在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和6.6g | (2)M的分子式为:C3H6O3. |
| (3)通过M的红外光谱图发现该分子中既有羟基,还有羧基(--COOH) | (3)写出M中含有官能团羟基的电子式: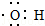 |
(4)M的核磁共振氢谱如图: | (4)M中含有4种氢原子. |
(5)综上所述,M的结构简式为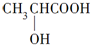 . . | |