题目内容
6.设NA为阿伏加德罗常数值,下列说法正确的是( )| A. | 1molFe与过量稀HNO3反应,电子转移数为2NA | |
| B. | 120g由NaHSO4和KHSO3组成的混合物含硫原子数为NA | |
| C. | 标准状况下,22.4LCH2Cl2含氯原子数为2 NA | |
| D. | 0.3mol/LAl(NO3)3溶液中含A13+数小于0.3 NA |
分析 A.转移电子数等于Fe失去的电子数;
B.NaHSO4和KHSO3的摩尔质量都是120g/mol,NaHSO4、KHSO3由2个离子组成;
C.标准状况下气体摩尔体积为22.4L/mol;
D.溶液体积不知不能计算微粒数.
解答 解:A.铁与足量的稀硝酸反应生成铁离子,1molFe失去3mol电子,即转移电子数为3NA个,故A错误;
B.NaHSO4由钠离子和硫酸氢根组成,KHSO3由钾离子和亚硫酸氢根组成,120g由NaHSO4和KHSO3组成的混合物物质的量=1mol,共含硫原子数为NA,故B正确;
C.标准状况下,22.4LCH2Cl2含物质的量不是1mol,故C错误;
D.0.3mol/LAl(NO3)3溶液中含A13+浓度为0.3mol/L,溶液体积不知不能计算微粒数,故D错误;
故选B.
点评 本题考查阿伏加德罗常数,题目难度中等,注意从物质的组成、结构、性质以及存在和条件和聚集状态等角度思考.

练习册系列答案
 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
16.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 1mol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子 | |
| C. | 1molCl2参加的氧化还原反应,反应过程中转移电子数都是2NA | |
| D. | 常温常压下,92gNO2和N2O4混合气体含有的原子数为6NA |
14.向分别含1molNaOH和1molBa(OH)2的混合溶液中通入amolCO2,下列说法不正确的是( )
| A. | 当a=l.0时,反应的离子方程式为:Ba2++2OH-+CO2═BaCO3↓+H2O | |
| B. | 当a=2时,反应的离子方程式为:Ba2++3OH-+2CO2═BaCO3↓+HCO3-+H2O | |
| C. | 当a=2.5时,反应的离子方程式为:OH-+CO2═HCO3- | |
| D. | 当a=1.75时,溶液中HCO3-与CO32-的物质的量之比为2:1 |
1.设NA为阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 10g质量分数为46%的乙醇水溶液中所含原子数目为0.6NA | |
| B. | 常温常压下,11.2L乙烯所含分子数目小于0.5NA | |
| C. | 常温常压下.4.4gN2O与CO2的混合气体中含的原子数目为0.3NA | |
| D. | 常温下,1molC5H12中含有共价键数为16NA |
11.下列选项中,利用相关实验器材(规格和数量不限)能够完成相应实验的是( )
| 选项 | 实验器材 | 相应实验 |
| A | 试管、铁架台、导管、酒精灯 | 乙酸乙酯的制备 |
| B | 锥形瓶、漏斗、双孔塞、导管、带余烬的木条、药匙 | 检验MnO2对H2O2分解速率的影响 |
| C | 500mL容量瓶、烧杯、玻璃棒、天平 | 配制 500mL1.00mol/LNaCl溶液 |
| D | 三脚架、坩埚、酒精灯、坩埚钳 | 钠在空气中燃烧 |
| A. | A | B. | B | C. | C | D. | D |
18.短周期元素W、X、Y、Z的原子序数依次增大,W与Y最外层电子数之和为X的最外层电子数的2倍,Z最外层电子数等于最内层电子数,X、Y、Z的简单离子的电子层结构相同,W的单质是空气中体积分数最大的气体.下列说法正确的是( )
| A. | 离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z) | |
| B. | Y的最高价氧化物对应水化物的酸性比W的强 | |
| C. | W的气态氢化物比X的稳定 | |
| D. | WX2与ZY2中的化学键类型相同 |
9.Na2O2是强氧化剂,也是航天航空、水下作业的供氧剂.
(1)Na2O2作供氧剂时,主要与人呼出的CO2反应,写出该反应的化学方程式,并用双线桥标明电子转移的方向和数目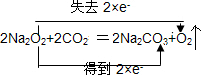 .
.
(2)航空和水下作业有时也会产生污染性气体,某学习小组欲探究Na2o2能否完全吸收氮氧化物、硫氧化物等污染性气体,设计了如下装置(未画完):
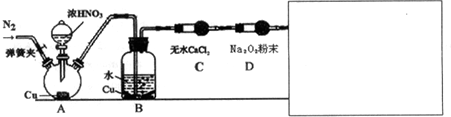
【资料信息】①酸性条件下,NO和NO2都能与MnO4-(H+)反应生成NO3-和Mn2+
②稀硝酸与Cu反应缓慢 ③2NO+Na2O2=2NaNO2
请在答题卷方框内补充完整装置示意图,并做必要标注.补充装置的作用是检验污染气体是否完全被Na2O2吸收,同时可防止污染气体排放到空气中.
(3)该学习小组中甲、乙、丙三位同学设计实验如下,完成表中空格(乙和丙同学对装置和试剂上进行了优化):
写出乙同学实验中D装置发生的化学方程式2NO2+Na2O2=2NaNO3.
(1)Na2O2作供氧剂时,主要与人呼出的CO2反应,写出该反应的化学方程式,并用双线桥标明电子转移的方向和数目
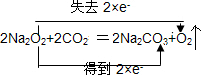 .
.(2)航空和水下作业有时也会产生污染性气体,某学习小组欲探究Na2o2能否完全吸收氮氧化物、硫氧化物等污染性气体,设计了如下装置(未画完):

【资料信息】①酸性条件下,NO和NO2都能与MnO4-(H+)反应生成NO3-和Mn2+
②稀硝酸与Cu反应缓慢 ③2NO+Na2O2=2NaNO2
请在答题卷方框内补充完整装置示意图,并做必要标注.补充装置的作用是检验污染气体是否完全被Na2O2吸收,同时可防止污染气体排放到空气中.
(3)该学习小组中甲、乙、丙三位同学设计实验如下,完成表中空格(乙和丙同学对装置和试剂上进行了优化):
| 实验学生 | 实验操作 | 现象与结论 |
| 甲 | 滴入浓硝酸前,需先打开弹簧夹,通入一段时间N2,目的是将装置中的空气排出.关闭弹簧夹,打开分液漏斗活塞,加入适量浓硝酸后关闭活塞. | 酸性高锰酸钾溶液不褪色,说明Na2O2能完全吸收NO, |
| 乙 | 去掉装置B,直接将A、C装置相连.打开分液漏斗活塞,加入适量浓硝酸后关闭活塞. | 与甲同学现象相似,说明Na2O2能完全吸收NO2 |
| 丙 | 在乙同学装置的基础上,将A装置中浓硝酸换成浓硫酸,并进行加热,(或将分液漏斗中的试剂换为浓硫酸,将铜换为亚硫酸钠粉末),打开分液漏斗活塞,加入适量试剂后关闭活塞. | 与甲同学现象相似,说明Na2O2能完全吸收NO2 |
10.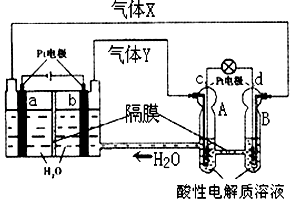 空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池.如图为RFC工作原理示意图,有关说法正确的是( )
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池.如图为RFC工作原理示意图,有关说法正确的是( )
 空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池.如图为RFC工作原理示意图,有关说法正确的是( )
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池.如图为RFC工作原理示意图,有关说法正确的是( )| A. | c极上进行还原反应,B中的H+可以通过隔膜进入A | |
| B. | d极上发生的电极反应是:O2+4H++4e-═2H2O | |
| C. | 该装置开始工作后,右端装置能量变化为:电能→化学能 | |
| D. | 当有0.2mol电子转移时,a极产生1.12L O2 |
 NO2与SO2能发生反应:NO2+SO2?SO3+NO,某研究小组对此进行相关实验探究.
NO2与SO2能发生反应:NO2+SO2?SO3+NO,某研究小组对此进行相关实验探究.