题目内容
7.用红色激光照射下列物质,能观察到丁达尔效应的是( )| A. | 乙醇溶液 | B. | 氢氧化铁胶体 | C. | 硫酸铜溶液 | D. | 蔗糖溶液 |
分析 丁达尔效应为胶体特有的性质,可以用于鉴别胶体与溶液,据此分析.
解答 解:乙醇溶液、硫酸铜溶液、蔗糖溶液都是溶液,不具有丁达尔效应,氢氧化铁胶体具有丁达尔效应,用红色激光照射,出现光亮通路,
故选:B.
点评 本题考查了胶体的性质,明确丁达尔效应是胶体特有性质是解题关键,注意对常见胶体积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.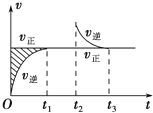 恒温密闭容器发生可逆反应:Z(?)+W(?)?X(g)+Y(?);△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中正确的是( )
恒温密闭容器发生可逆反应:Z(?)+W(?)?X(g)+Y(?);△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中正确的是( )
 恒温密闭容器发生可逆反应:Z(?)+W(?)?X(g)+Y(?);△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中正确的是( )
恒温密闭容器发生可逆反应:Z(?)+W(?)?X(g)+Y(?);△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中正确的是( )| A. | Z和W在该条件下有一种是为气态 | |
| B. | t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等 | |
| C. | 若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等 | |
| D. | 若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大 |
2. 汽车尾气是造成雾霾天气的原因之一.
汽车尾气是造成雾霾天气的原因之一.
(1)汽车尾气中含有CO、NO2等有毒气体对汽车加装尾气净化装置可使有毒气体相互反应转化为无毒气体. 写出该反应的热化学方程式4CO(g)+2NO2(g)=4CO2(g)+N2(g)△=-1200.0kJ/mol.
N2(g)+2O2(g)═2NO2(g)△H=+68.0kJ•mol-1;
2C(s)+O2(g)═2CO(g)△H=-221.0kJ•mol-1;
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
(2)汽车尾气中含有CO和H2O(g)在一定条件下可以发生反应
CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.850℃在体积为10L反应器中通入一定量的CO和H2O(g)发生上述反应CO和H2O(g)的浓度变化如图所示则0-4min是平均反应速率v(H2O)=0.03mol•L-1•min-1此时K=1.
850℃在甲、乙、丙三个1L的恒容密闭容器中,起始时按照表进行投料,达到平衡状态.平衡时甲容器中CO的转化率是50%.比较下列容器中CO的转化率甲<乙(填“大于”、“<”或“等于”).
 汽车尾气是造成雾霾天气的原因之一.
汽车尾气是造成雾霾天气的原因之一.(1)汽车尾气中含有CO、NO2等有毒气体对汽车加装尾气净化装置可使有毒气体相互反应转化为无毒气体. 写出该反应的热化学方程式4CO(g)+2NO2(g)=4CO2(g)+N2(g)△=-1200.0kJ/mol.
N2(g)+2O2(g)═2NO2(g)△H=+68.0kJ•mol-1;
2C(s)+O2(g)═2CO(g)△H=-221.0kJ•mol-1;
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
(2)汽车尾气中含有CO和H2O(g)在一定条件下可以发生反应
CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.850℃在体积为10L反应器中通入一定量的CO和H2O(g)发生上述反应CO和H2O(g)的浓度变化如图所示则0-4min是平均反应速率v(H2O)=0.03mol•L-1•min-1此时K=1.
| 起始物质的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
12.下列说法中正确的是( )
| A. | 1 mol H2中含有6.02×1023个H | B. | 1 mol氧含有6.02×1023个O2 | ||
| C. | 1 mol CaCl2溶液里含有1 mol离子 | D. | 1 mol H+中含有H+数为NA |
16.下列表述正确的是( )
| A. | 醛基的结构简式-COH | B. | 聚丙烯的结构简式  | ||
| C. | 四氯化碳分子的电子式  | D. | 丙烷分子的球棍模型  |
17.自然界为人类提供了多种多样的营养物质,下列有关说法不正确的是( )
| A. | 葡萄糖与银氨溶液反应会产生银镜现象 | |
| B. | 生吃新鲜蔬菜要比熟吃时维生素C的损失小 | |
| C. | 油脂在人体内酶的催化作用下水解为氨基酸 | |
| D. | 不慎误食重金属盐离子,应立即喝大量牛奶来缓解毒性,以减少人体蛋白质中毒的程度 |
 以NaCl等为原料制备KClO4的过程如下:
以NaCl等为原料制备KClO4的过程如下: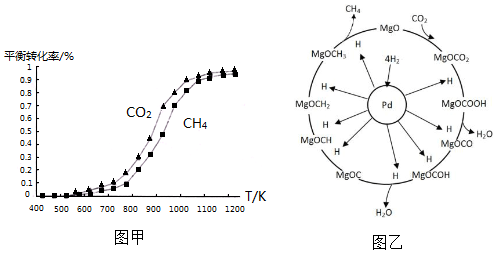 ①同温度下CO2的平衡转化率大于(填“大于”或“小于”)CH4的平衡转化率,其原因是CO2发生了其他副反应.
①同温度下CO2的平衡转化率大于(填“大于”或“小于”)CH4的平衡转化率,其原因是CO2发生了其他副反应. CH4+2H2O.
CH4+2H2O.