题目内容
14.我国稀土资源丰富,下列有关稀土元素${\;}_{62}^{144}Sm$与${\;}_{62}^{150}Sm$的说法正确的是( )| A. | ${\;}_{62}^{144}Sm$与${\;}_{62}^{150}Sm$互为同位素 | |
| B. | ${\;}_{62}^{144}Sm$与${\;}_{62}^{150}Sm$的质量数相同 | |
| C. | ${\;}_{62}^{144}Sm$与${\;}_{62}^{150}Sm$是同一种核素 | |
| D. | ${\;}_{62}^{144}Sm$与${\;}_{62}^{150}Sm$的核外电子数和中子数均为62 |
分析 14462Sm与15062Sm的质子数相同,中子数不同,则互为同位素,结合原子的构成来解答.
解答 解:A.14462Sm与15062Sm的质子数均为62,但中子数分别为82、88,则互为同位素,故A正确;
B.14462Sm与15062Sm的质量数分别为144、150,故B错误;
C.14462Sm与15062Sm的质子数相同,中子数不同,为不同的核素,故C错误;
D.14462Sm与15062Sm的质子数和电子数均为62,中子数不同,故D错误;
故选A.
点评 本题考查原子的构成及同位素,明确不同位置的数字的意义、原子中的数量关系即可解答,较简单.

练习册系列答案
相关题目
2. 汽车尾气是造成雾霾天气的原因之一.
汽车尾气是造成雾霾天气的原因之一.
(1)汽车尾气中含有CO、NO2等有毒气体对汽车加装尾气净化装置可使有毒气体相互反应转化为无毒气体. 写出该反应的热化学方程式4CO(g)+2NO2(g)=4CO2(g)+N2(g)△=-1200.0kJ/mol.
N2(g)+2O2(g)═2NO2(g)△H=+68.0kJ•mol-1;
2C(s)+O2(g)═2CO(g)△H=-221.0kJ•mol-1;
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
(2)汽车尾气中含有CO和H2O(g)在一定条件下可以发生反应
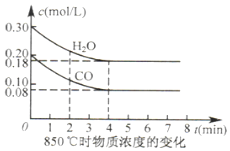
CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.850℃在体积为10L反应器中通入一定量的CO和H2O(g)发生上述反应CO和H2O(g)的浓度变化如图所示则0-4min是平均反应速率v(H2O)=0.03mol•L-1•min-1此时K=1.
850℃在甲、乙、丙三个1L的恒容密闭容器中,起始时按照表进行投料,达到平衡状态.平衡时甲容器中CO的转化率是50%.比较下列容器中CO的转化率甲<乙(填“大于”、“<”或“等于”).
 汽车尾气是造成雾霾天气的原因之一.
汽车尾气是造成雾霾天气的原因之一.(1)汽车尾气中含有CO、NO2等有毒气体对汽车加装尾气净化装置可使有毒气体相互反应转化为无毒气体. 写出该反应的热化学方程式4CO(g)+2NO2(g)=4CO2(g)+N2(g)△=-1200.0kJ/mol.
N2(g)+2O2(g)═2NO2(g)△H=+68.0kJ•mol-1;
2C(s)+O2(g)═2CO(g)△H=-221.0kJ•mol-1;
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
(2)汽车尾气中含有CO和H2O(g)在一定条件下可以发生反应
CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.850℃在体积为10L反应器中通入一定量的CO和H2O(g)发生上述反应CO和H2O(g)的浓度变化如图所示则0-4min是平均反应速率v(H2O)=0.03mol•L-1•min-1此时K=1.
| 起始物质的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
9.关于“用CCl4萃取碘的饱和水溶液中的碘”的实验,下列说法正确的是( )
| A. | 使用的实验仪器是容量瓶和烧杯 | |
| B. | 静置后所得液体上层呈紫红色 | |
| C. | 碘在CCl4中的溶解度比在水中的溶解度小 | |
| D. | 如果把CCl4加入碘的不饱和水溶液中,萃取碘的实验也可以成功 |
6.室温下,下列各离子组在指定的溶液中一定能够大量共存的是( )
| A. | 在无色的溶液中:K+、Na+、MnO4-、SO42- | |
| B. | 在pH=11的溶液中:CO32-、Na+、NO3-、SO42- | |
| C. | 水电离出的c(H+)=10-12mol•L?1的溶液中:Cl-、HCO3-、NO3-、NH4+ | |
| D. | 在酸性溶液中:Na+、NH4+、SO42-、S2O32- |
3.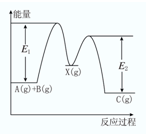 反应A(g)+B(g)→C(g)△H,分两步进行:①A(g)+B(g)→X(g)△H1,②X(g)→C(g)△H2,反应过程中能量变化如图所示,E1表示A(g)+B(g)→X(g)的活化能,下列说法正确的是( )
反应A(g)+B(g)→C(g)△H,分两步进行:①A(g)+B(g)→X(g)△H1,②X(g)→C(g)△H2,反应过程中能量变化如图所示,E1表示A(g)+B(g)→X(g)的活化能,下列说法正确的是( )
 反应A(g)+B(g)→C(g)△H,分两步进行:①A(g)+B(g)→X(g)△H1,②X(g)→C(g)△H2,反应过程中能量变化如图所示,E1表示A(g)+B(g)→X(g)的活化能,下列说法正确的是( )
反应A(g)+B(g)→C(g)△H,分两步进行:①A(g)+B(g)→X(g)△H1,②X(g)→C(g)△H2,反应过程中能量变化如图所示,E1表示A(g)+B(g)→X(g)的活化能,下列说法正确的是( )| A. | △H=E1-E2 | B. | E1是反应①的活化能 | ||
| C. | X是反应A(g)+B(g)→C(g)的催化剂 | D. | △H2>0 |
4.某结晶水合物的化学式为R.xH2O其相对分子质量为M,在25℃时ag晶体溶于bg水中,即达饱和,形成VmL溶液,则下列表达式中不正确的是( )
| A. | 饱和溶液的密度$\frac{(a+b)}{V}$ | |
| B. | 饱和溶液的物质的量浓度$\frac{100a(M-18x)}{MV}$ | |
| C. | 25℃,R的溶解度$\frac{100a(M-18x)}{(bM+18ax)}$ | |
| D. | 饱和溶液的质量分数$\frac{a(M-18x)}{(a+b)M}$ |
 ,含有离子键和非极性共价键的化合物的电子式为
,含有离子键和非极性共价键的化合物的电子式为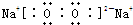 ;含有极性共价键和非极性共价键的化合物的电子式为
;含有极性共价键和非极性共价键的化合物的电子式为 .
. 一定条件下,在体积为3L的密闭容器中,CO与H2反应生成甲醇(CH3OH)(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).完成下列各题:
一定条件下,在体积为3L的密闭容器中,CO与H2反应生成甲醇(CH3OH)(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).完成下列各题: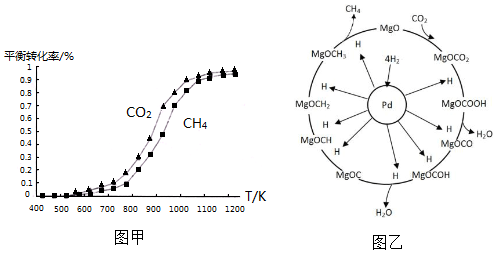 ①同温度下CO2的平衡转化率大于(填“大于”或“小于”)CH4的平衡转化率,其原因是CO2发生了其他副反应.
①同温度下CO2的平衡转化率大于(填“大于”或“小于”)CH4的平衡转化率,其原因是CO2发生了其他副反应. CH4+2H2O.
CH4+2H2O.