题目内容
2.25℃时,水的电离达到平衡:H2O?H++OH-△H>0,下列叙述正确的是( )| A. | 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| B. | 向水中加入氨水,平衡逆向移动,c(OH-)降低 | |
| C. | 向水中加入金属钠,平衡正向移动,c(H+)增大 | |
| D. | 将水加热,KW增大,pH不变 |
分析 A.硫酸氢钠是强电解质,在水溶液中电离方程式为NaHSO4=Na++H++SO42-,离子积常数只与温度有关;
B.加入氨水后溶液中c(OH-)增大;
C.加入Na,Na和水反应生成NaOH导致溶液中c(OH-)增大;
D.该反应的正反应是吸热反应,升高温度平衡正向移动,但溶液中c(H+)增大.
解答 解:A.硫酸氢钠是强电解质,在水溶液中电离方程式为NaHSO4=Na++H++SO42-,加入硫酸氢钠后c(H+)增大,温度不变导致Kw不变,故A正确;
B.加入氨水后一水合氨电离导致溶液中c(OH-)增大,平衡逆向移动,故B错误;
C.加入Na,Na和水反应生成NaOH导致溶液中c(OH-)增大,温度不变,离子积常数不变,所以c(H+)减小,故C错误;
D.该反应的正反应是吸热反应,升高温度平衡正向移动,KW增大,但溶液中c(H+)增大,导致溶液的pH减小,但仍然呈中性,故D错误;
故选A.
点评 本题考查离子积常数及水的电离,为高频考点,明确水电离原理及外界条件对水电离影响是解本题关键,注意:离子积常数只与温度有关,与溶液酸碱性及溶液浓度大小无关,注意C中隐含信息的挖掘,题目难度不大.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
10.常温下,体积相同、物质的量浓度相同的三种盐NaX、NaY、NaZ的溶液pH分别为7、9、10,则下列说法不正确的是( )
| A. | 酸性强弱HX>HY>HZ | B. | 有两种盐能发生水解 | ||
| C. | 分别稀释上述三种溶液,pH均变小 | D. | 三种溶液中离子总数不相同 |
14.设阿伏加德罗常数为NA,则下列说法正确的是( )
| A. | 15g甲基(-CH3)所含有的电子数是9NA | |
| B. | 7.8g 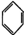 中含有的碳碳双键数为0.3NA 中含有的碳碳双键数为0.3NA | |
| C. | 1mol C2H5OH和1mol CH3CO18OH反应生成水的中子数为8NA | |
| D. | 标准状况下,11.2L己烷所含分子数为0.5NA |
11.下列表示物质结构的化学用语或模型正确的是( )
| A. | 硫酸的电离方程式:H2SO4=H2++SO42- | |
| B. | CO2的电子式: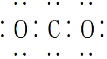 | |
| C. | Cl-离子的结构示意图: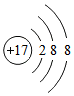 | |
| D. | 苯的结构简式:C6H6 |

