题目内容
9.下列清洁剂能与常用的肥皂最为接近的是( )| A. | CH3-(CH2)11C6H4-SO3Na | B. | CH3-(CH2)13-COOK | ||
| C. | CH3-(CH2)11-SO3Na | D. | CH3(CH2)nCH3(5≤n≤12) |
分析 肥皂的主要成为硬脂肪酸钠盐,故清洁剂成分的结构应该与此结构相似,据此回答.
解答 解:肥皂的主要成分是高级脂肪酸钠,即为高级脂肪酸与碱形成的羧酸盐,清洁剂成分的结构应该与此结构相似,四个选项中只有选项B符合条件.
故选B.
点评 本题考查了肥皂的主要成分,为教材上的基础知识,要求学生知道肥皂的组成即可,难度较小.

练习册系列答案
相关题目
16.现有部分短周期元素的性质或原子结构如表:
(1)用化学用语回答下列问题:
①A元素在周期表中的位置第三周期第ⅥA族;②C单质分子的电子式 ;
;
③D的原子结构示意图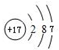 ;④电子式表示A和B元素组成的化合物的形成过程:
;④电子式表示A和B元素组成的化合物的形成过程: .
.
(2)元素D与元素A相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bde(填选项序号).
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
d.A最高价含氧酸的酸性弱于D最高价含氧酸
e.D单质能与A的氢化物反应生成A单质
(3)X是由A、B、C、D四种元素中的某种元素组成的单质,能经图所示的过程转化为(其他条件略去).
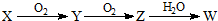
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,无现象,然后滴加适量H2O2溶液,有白色沉淀生成,则该白色沉淀为BaSO4,试写出Y与H2O2溶液反应的化学方程式:SO2+H2O2=H2SO4;
②若Z是红棕色气体,则Z→W的反应中氧化剂与还原剂物质的量之比为1:2.
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
①A元素在周期表中的位置第三周期第ⅥA族;②C单质分子的电子式
 ;
;③D的原子结构示意图
 ;④电子式表示A和B元素组成的化合物的形成过程:
;④电子式表示A和B元素组成的化合物的形成过程: .
.(2)元素D与元素A相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bde(填选项序号).
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
d.A最高价含氧酸的酸性弱于D最高价含氧酸
e.D单质能与A的氢化物反应生成A单质
(3)X是由A、B、C、D四种元素中的某种元素组成的单质,能经图所示的过程转化为(其他条件略去).
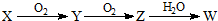
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,无现象,然后滴加适量H2O2溶液,有白色沉淀生成,则该白色沉淀为BaSO4,试写出Y与H2O2溶液反应的化学方程式:SO2+H2O2=H2SO4;
②若Z是红棕色气体,则Z→W的反应中氧化剂与还原剂物质的量之比为1:2.
17.常温下,浓度均为0.1mlo•L-1的HX、HY溶液各20mL,分别用0.1mol•L-1的Na0H溶液滴定.溶液的pH与所用Na0H的体积V关系如图所示,下列推断不正确的是( )

| A. | 相同条件下,HX和HY中和碱的能力相同 | |
| B. | 常温下,HX的电离平衡常数K=1×10-9mol•L-1 | |
| C. | 点存在:c(X-)-c(HX)>c(H+)-c(0H-) | |
| D. | 向B点溶液通人HCl气体至中性:c(HX)+c(Cl-)+2c(X-)=0.2mol•L-1A |
14.下列化学用语正确的是( )
| A. | 双氧水使酸性KMnO4溶液的红色褪去:3H2O2+2MnO4-+6H+=2Mn2++4O2↑+6H2O | |
| B. | HClO4的电离方程式:HClO4=H++ClO4- | |
| C. | 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O | |
| D. | Fe2+被空气氧化:4Fe2++O2+2H2O=4Fe3++4OH- |
14.图为两种途径制备硫酸的过程,反应条件略.下列说法错误的是( )
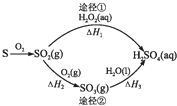

| A. | 已知S(l)+O2(g)═SO2(g)△H=-293.23kJ•mol-1,则S(s)+O2(g)═SO2(g)反应放出的热量小于293.23 kJ/mol | |
| B. | 含1 mol H2SO4的浓溶液与足量NaOH反应,放出的热量即为中和热 | |
| C. | 途径②中SO2和SO3均属于酸性氧化物 | |
| D. | 若△H1<△H2+△H3,则2H2O2(aq)═2H2O(l)+O2(g)为放热反应 |
1.下列离子能大量共存的是( )
| A. | 无色酚酞试液呈红色的溶液中:Na+、K+、SO42-、CO32- | |
| B. | 无色透明的溶液中:Cu2+、K+、SO42-、NO3- | |
| C. | 含有大量Ba(NO3)2的溶液中:Mg2+、NH4+、SO42-、Cl- | |
| D. | 紫色石蕊试液呈红色的溶液中:Ca2+、Cl-、Na+、HCO3- |
18.表是元素周期表的一部分,针对表中标出的①~⑩元素,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为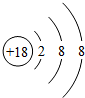 ;
;
(2)表中金属性最强的元素是Na(用元素符号表示,下同),非金属性最强的元素是F,可作半导体材料的是Si元素的单质;
(3)表中能形成两性氢氧化物的元素是Al,写出该元素的单质与⑨的最高价氧化物的水化物反应的化学方程式2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
(4)⑨的最高价氧化物的水化物所含化学键类型离子键、共价键;
(5)①、⑥、⑦三种元素的最高价氧化物的水化物中酸性最强的是HClO4(填化学式);
(6)元素①的最高价氧化物的电子式 ,④元素与⑦元素形成化合物的电子式
,④元素与⑦元素形成化合物的电子式 .
.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ⑨ | ④ | ⑤ | ⑩ | ⑥ | ⑦ | ⑧ |
 ;
;(2)表中金属性最强的元素是Na(用元素符号表示,下同),非金属性最强的元素是F,可作半导体材料的是Si元素的单质;
(3)表中能形成两性氢氧化物的元素是Al,写出该元素的单质与⑨的最高价氧化物的水化物反应的化学方程式2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
(4)⑨的最高价氧化物的水化物所含化学键类型离子键、共价键;
(5)①、⑥、⑦三种元素的最高价氧化物的水化物中酸性最强的是HClO4(填化学式);
(6)元素①的最高价氧化物的电子式
 ,④元素与⑦元素形成化合物的电子式
,④元素与⑦元素形成化合物的电子式 .
.
19.下列有关实验操作说法正确的是( )
| A. | 除去NaCl晶体中少量KNO3,可以将混合物制成热的饱和溶液,然后冷却结晶,过滤,洗涤,干燥 | |
| B. | 在食醋总酸含量测定实验中,配制NaOH标准溶液后需要用邻苯二甲酸氢钾对该溶液浓度进行标定 | |
| C. | 海洋植物具有富集碘的能力,因此从海产品中提取碘是工业上获取碘的重要途径.工业从海带中提取碘经历的步骤有:浸泡-过滤-氧化-萃取-粗碘提纯 | |
| D. | 在洁净试管中加入2mL 10% NaOH溶液,再加入等量的CuSO4溶液,制得的新制氢氧化铜悬浊液可用于检验糖尿病人尿液中葡萄糖含量是否偏高 |