题目内容
3.下列说法正确的是( )| A. | 同一主族相邻两个周期的元素的原子序数差为上一周期所含元素种类 | |
| B. | 短周期元素中同主族元素X的原子序数不可能是Y的2倍 | |
| C. | L层上的电子数为奇数的元素一定是主族元素 | |
| D. | 目前使用的元素周期表中,最长的周期含36种元素 |
分析 A.在周期表的左侧时,同一主族相邻两个周期的元素的原子序数差为上一周期所含元素种类;在周期表的右侧时,同一主族相邻两个周期的元素的原子序数差为下一周期所含元素种类;
B.X为S、Y为O,原子序数为2倍关系;
C.L层上的电子数为奇数的元素,一定只有2个电子层;
D.目前使用的元素周期表中,第六周期含32种元素.
解答 解:A.在周期表的左侧时,同一主族相邻两个周期的元素的原子序数差为上一周期所含元素种类,故A错误;
B.若X为S、Y为O,可知短周期元素中同主族元素X的原子序数可能是Y的2倍,故B错误;
C.L层上的电子数为奇数的元素,一定只有2个电子层,位于第二周期,则一定是主族元素,故C正确;
D.目前使用的元素周期表中,第六周期含32种元素,第七周期若排满也为32种,故D错误;
故选C.
点评 本题考查元素周期表的结构及应用,为高频考点,把握周期表的结构、元素的性质为解答的关键,侧重分析与应用能力的考查,注意目前周期表的结构,题目难度不大.

练习册系列答案
相关题目
10.已知重铬酸钾(K2Cr2O7)溶液中存在如下平衡:Cr2O7 2-(橙色)+H2O?2H++2CrO42- (黄色),
①向2mL 0.1mol•L-1 K2Cr2O7溶液中滴入3滴6mol•L-1 NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色
②向2mL 0.1mol•L-1 酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O7 2-+14H++6Fe2+=2Cr3+(绿色)+6Fe3++7H2O.
下列分析正确的是( )
①向2mL 0.1mol•L-1 K2Cr2O7溶液中滴入3滴6mol•L-1 NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色
②向2mL 0.1mol•L-1 酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O7 2-+14H++6Fe2+=2Cr3+(绿色)+6Fe3++7H2O.
下列分析正确的是( )
| A. | 实验①和②均能证明K2Cr2O7溶液中存在上述平衡 | |
| B. | 实验②能说明氧化性:Cr2O7 2->Fe3+ | |
| C. | CrO42- 和Fe2+在酸性溶液中可以大量共存 | |
| D. | 稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 |
14.图为两种途径制备硫酸的过程,反应条件略.下列说法错误的是( )
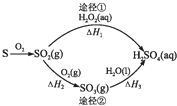

| A. | 已知S(l)+O2(g)═SO2(g)△H=-293.23kJ•mol-1,则S(s)+O2(g)═SO2(g)反应放出的热量小于293.23 kJ/mol | |
| B. | 含1 mol H2SO4的浓溶液与足量NaOH反应,放出的热量即为中和热 | |
| C. | 途径②中SO2和SO3均属于酸性氧化物 | |
| D. | 若△H1<△H2+△H3,则2H2O2(aq)═2H2O(l)+O2(g)为放热反应 |
11.化学科学需要借助化学专用语言来描述,下列有关化学用语正确( )
| A. | CO2的电子式为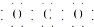 | B. | Cl-的结构示意图为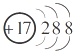 | ||
| C. | NaCl的电子式为Na+Cl- | D. | HCl的电子式为HCl |
18.表是元素周期表的一部分,针对表中标出的①~⑩元素,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为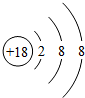 ;
;
(2)表中金属性最强的元素是Na(用元素符号表示,下同),非金属性最强的元素是F,可作半导体材料的是Si元素的单质;
(3)表中能形成两性氢氧化物的元素是Al,写出该元素的单质与⑨的最高价氧化物的水化物反应的化学方程式2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
(4)⑨的最高价氧化物的水化物所含化学键类型离子键、共价键;
(5)①、⑥、⑦三种元素的最高价氧化物的水化物中酸性最强的是HClO4(填化学式);
(6)元素①的最高价氧化物的电子式 ,④元素与⑦元素形成化合物的电子式
,④元素与⑦元素形成化合物的电子式 .
.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ⑨ | ④ | ⑤ | ⑩ | ⑥ | ⑦ | ⑧ |
 ;
;(2)表中金属性最强的元素是Na(用元素符号表示,下同),非金属性最强的元素是F,可作半导体材料的是Si元素的单质;
(3)表中能形成两性氢氧化物的元素是Al,写出该元素的单质与⑨的最高价氧化物的水化物反应的化学方程式2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
(4)⑨的最高价氧化物的水化物所含化学键类型离子键、共价键;
(5)①、⑥、⑦三种元素的最高价氧化物的水化物中酸性最强的是HClO4(填化学式);
(6)元素①的最高价氧化物的电子式
 ,④元素与⑦元素形成化合物的电子式
,④元素与⑦元素形成化合物的电子式 .
.
8.某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或多种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):

关于该固体混合物,下列说法正确的是( )

关于该固体混合物,下列说法正确的是( )
| A. | 一定含有Al,其质量为2.7g | |
| B. | 一定含有(NH4)2SO4和MgCl2,且物质的量相等 | |
| C. | 一定含有MgCl2和FeCl2 | |
| D. | 一定不含FeCl2,可能含有MgCl2和AlCl3 |
15.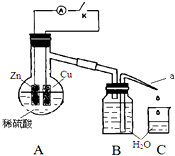 某同学分析Zn与稀H2SO4的反应.
某同学分析Zn与稀H2SO4的反应.
(1)该反应的离子方程式是Zn+2H+=Zn2++H2↑.
(2)制H2时,用稀硫酸而不用浓硫酸,原因是浓H2SO4具有强氧化性,不能生成氢气.
(3)已知:Zn(s)+$\frac{1}{2}$O2(g)=ZnO(s)△H=-332kJ/mol
ZnO(s)+H2SO4(aq)=ZnSO4(aq)+H2O(l)△H=-112kJ/mol
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286kJ/mol
则Zn与稀H2SO4反应生成1mol H2 时的反应热△H=-158kJ/mol.
(4)该同学用如图装置进行实验,分析影响反应速率的因素.
实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如下表所示:
分析反应过程中的水滴数,请回答:
①由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快(填“快”或“慢”),主要原因是形成原电池反应速度快.
②由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是溶液中的c(H+)大于闭合K时溶液中的c(H+).
③从能量转换形式不同的角度,分析水滴数86>81、117>112的主要原因是断开K时,反应的化学能主要转化成热能,闭合K时,反应的化学能主要转化成电能,前者使溶液的温度升得更高,故反应速率更快.
 某同学分析Zn与稀H2SO4的反应.
某同学分析Zn与稀H2SO4的反应.(1)该反应的离子方程式是Zn+2H+=Zn2++H2↑.
(2)制H2时,用稀硫酸而不用浓硫酸,原因是浓H2SO4具有强氧化性,不能生成氢气.
(3)已知:Zn(s)+$\frac{1}{2}$O2(g)=ZnO(s)△H=-332kJ/mol
ZnO(s)+H2SO4(aq)=ZnSO4(aq)+H2O(l)△H=-112kJ/mol
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286kJ/mol
则Zn与稀H2SO4反应生成1mol H2 时的反应热△H=-158kJ/mol.
(4)该同学用如图装置进行实验,分析影响反应速率的因素.
实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如下表所示:
| 1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
| 1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
①由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快(填“快”或“慢”),主要原因是形成原电池反应速度快.
②由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是溶液中的c(H+)大于闭合K时溶液中的c(H+).
③从能量转换形式不同的角度,分析水滴数86>81、117>112的主要原因是断开K时,反应的化学能主要转化成热能,闭合K时,反应的化学能主要转化成电能,前者使溶液的温度升得更高,故反应速率更快.
12.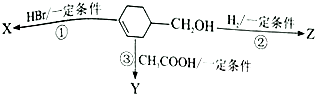 有机物
有机物 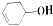 可发生如下图示反应,已知产物Y属于脂类.下列说法正确的是( )
可发生如下图示反应,已知产物Y属于脂类.下列说法正确的是( )
 有机物
有机物  可发生如下图示反应,已知产物Y属于脂类.下列说法正确的是( )
可发生如下图示反应,已知产物Y属于脂类.下列说法正确的是( )| A. | 反应③的条件是稀硫酸、加热 | B. | 反应①②的类型不可能相同 | ||
| C. | 有机产物X是一种纯净物 | D. | Y、Z均可使酸性高锰酸钾溶液褪色 |
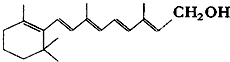 已知维生素A1的键线式如下,线的交点与端点处代表碳原子,并用氢原子补足四价,但C、H原子未标记出来.
已知维生素A1的键线式如下,线的交点与端点处代表碳原子,并用氢原子补足四价,但C、H原子未标记出来.