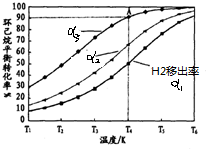
题目内容
8.实验室用图所示装置制备AlCl3溶液,并用AlCl3溶液溶解一定量的CaCO3形成溶液,再用氨水沉淀,然后煅烧沉淀制备新型的超导材料和发光材料七铝十二钙(12CaO•7Al2O3).已知AlCl3易水解,易升华.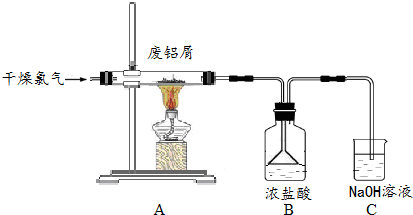
(1)实验室用氯酸钾和浓盐酸制备氯气,其离子方程式为ClO3-+5Cl-+6H+=3Cl2+3H2O;C装置的作用吸收氯气,防止污染空气.
(2)氯气与废铝屑反应生成的AlCl3蒸气溶解在B中浓盐酸,为了防止AlCl3蒸气凝华堵塞导管,实验中可采取的措施是加粗导管、缩短导管长度、加热导管、通入氮气等.
(3)AlCl3溶液溶解CaCO3时,AlCl3溶液和碳酸钙粉末的混合方式为碳酸钙粉末慢慢加入到AlCl3溶液中.
(4)实验要控制碳酸钙和AlCl3的量,要求n(CaCO3):n(AlCl3)>12:7,其原因是氢氧化钙微溶于水,造成损失.
(5)用白云石(主要成分为CaCO3、MgCO3)制备纯净碳酸钙的实验方案为:将一定量的白云石煅烧,用硝酸铵溶液溶解煅烧后的固体,过滤,向所得滤液中通入二氧化碳,调节PH值11-12,过滤出碳酸钙沉淀.(实验中需用到的试剂有:硝酸铵溶液,氨气,二氧化碳;需要用到的仪器:pH计.
已知:镁的化合物不溶于硝酸铵溶液;pH值为11~12时得到较纯净碳酸钙沉淀).
分析 实验室用氯气与铝反应制备AlCl3,AlCl3再用水吸收得AlCl3溶液,由于AlCl3易水解,所以吸收氯化铝要用盐酸溶液,氯化铝易溶于水,所以装置B中用防止倒吸装置,实验中有氯气尾气,有氢氧化钠溶液吸收,用制得的AlCl3溶液溶解一定量的CaCO3形成溶液,再用氨水沉淀,然后锻烧可得12CaO•7Al2O3),
(1)实验室用氯酸钾氧化浓盐酸制备氯气,生成氯气和氯化钾及水,根据电荷守恒和元素守恒书写离子方程式;实验中有氯气尾气,会污染空气;
(2)AlCl3易水解,所以吸收氯化铝要用盐酸溶液,为了防止AlCl3蒸气凝华堵塞导管,实验中加粗导管、缩短导管长度、加热导管、通入氮气等;
(3)B装置中的AlCl3溶液溶解CaCO3时,AlCl3溶液水解呈酸性,所以在混合时可以将碳酸钙粉末慢慢加到氯化铝溶液中,便于碳酸钙溶解;
(4)由于氢氧化钙微溶于水,钙元素会有损失,所以碳酸钙要适当过量;
(5)用白云石(主要成分为CaCO3、MgCO3)制备纯净碳酸钙,要除去原料中的镁离子,由于镁的化合物不溶于硝酸铵溶液,所以要除去碳酸镁,先将固体煅烧,再用硝酸铵溶液溶解煅烧后的固体,然后过滤,向所得滤液中通入二氧化碳,调节PH值11-12,过滤可得碳酸钙沉淀;
解答 解:实验室用氯气与铝反应制备AlCl3,AlCl3再用水吸收得AlCl3溶液,由于AlCl3易水解,所以吸收氯化铝要用盐酸溶液,氯化铝易溶于水,所以装置B中用防止倒吸装置,实验中有氯气尾气,有氢氧化钠溶液吸收,用制得的AlCl3溶液溶解一定量的CaCO3形成溶液,再用氨水沉淀,然后锻烧可得12CaO•7Al2O3),
(1)实验室用氯酸钾氧化浓盐酸制备氯气,生成氯气和氯化钾及水,反应的离子方程式为ClO3-+5Cl-+6H+=3Cl2+3H2O,实验中有氯气尾气,会污染空气,所以用C装置中氢氧化钠进行尾气吸收,吸收氯气,防止污染空气,
故答案为:ClO3-+5Cl-+6H+=3Cl2+3H2O;吸收氯气,防止污染空气;
(2)AlCl3易水解,所以吸收氯化铝要用盐酸溶液,为了防止AlCl3蒸气凝华堵塞导管,实验中加粗导管、缩短导管长度、加热导管、通入氮气等,
故答案为:加粗导管、缩短导管长度、加热导管、通入氮气等;
(3)B装置中的AlCl3溶液溶解CaCO3时,AlCl3溶液水解呈酸性,所以在混合时可以将碳酸钙粉末慢慢加到氯化铝溶液中,便于碳酸钙溶解,
故答案为:碳酸钙粉末慢慢加入到AlCl3溶液中;
(4)由于氢氧化钙微溶于水,钙元素会有损失,所以碳酸钙要适当过量,
故答案为:氢氧化钙微溶于水,造成损失;
(5)用白云石(主要成分为CaCO3、MgCO3)制备纯净碳酸钙,要除去原料中的镁离子,由于镁的化合物不溶于硝酸铵溶液,所以要除去碳酸镁,先将固体煅烧,再用硝酸铵溶液溶解煅烧后的固体,然后过滤,向所得滤液中通入二氧化碳,调节PH值11-12,过滤可得碳酸钙沉淀,
故答案为:用硝酸铵溶液溶解煅烧后的固体,过滤,向所得滤液中通入二氧化碳,调节PH值11-12,过滤出碳酸钙沉淀.
点评 本题综合考查物质的制备以及分离提纯、实验基本操作等,为高考常见题型,侧重于学生的分析、实验能力的考查,注意把握物质的性质以及题目给予的信息,难度中等.

| A. | 硫酸氢钠溶液与氢氧化钡溶液恰好反应呈中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | |
| B. | 向石灰水中加入过量小办打溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| C. | 向Ca(ClO)2中通放少量CO2:2ClO -+CO2+H2O=2HClO+CO32- | |
| D. | 用稀硝酸除去试管内壁的银镜:Ag+NO3-+2H+=Ag++NO2↑+H2O |
| A. | 植物油不能与氢气发生加成反应 | B. | 葡萄糖能发生氧化反应和水解反应 | ||
| C. | 淀粉水解的最终产物是葡萄糖 | D. | 蛋白质遇浓硫酸变为黄色 |
| A. | CH≡C-CH2CH3 | B. | CH3C≡CH | C. | CH3CH2CH═CH2 | D. | CH2═CH-CH═CH2 |
 某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究.
某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究.【查阅资料】25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
【实验探究】向2支均盛有1mL 0.1mol/L MgCl2溶液的试管中分别加入2滴2mol/L NaOH溶液,制得等量Mg(OH)2沉淀.
(1)分别向两支试管中加入不同试剂,记录实验现象如表:
| 试管编号 | 加入试剂 | 实验现象 |
| Ⅰ | 2滴0.1mol/L FeCl3溶液 | ①白色沉淀转化为红褐色沉淀 |
| Ⅱ | 4mL 2 mol/L NH4Cl 溶液 | ②白色沉淀溶解,得无色溶液 |
(3)同学们猜想实验Ⅱ中沉淀溶解的主要原因有两种:
猜想1:NH4+结合Mg(OH)2电离出的OH-,使Mg(OH)2的溶解平衡正向移动.
猜想2:NH4Cl水解出来的H+与Mg(OH)2电离出OH-结合成水,使Mg(OH)2的溶解平衡正向移动.
(4)为验证猜想,同学们取少量相同质量的氢氧化镁盛放在两支试管中,一支试管中加入醋酸铵溶液(pH=7),另一支试管中加入NH4Cl和氨水混合液(pH=8),两者沉淀均溶解.
①实验证明猜想正确的是1(填“1”或“2”).
②验证猜想时,设计实验向氢氧化镁沉淀中加NH4Cl和氨水混合液的理由是做对比分析,pH=8的NH4Cl和氨水混合液中c(H+)很小,可以否定猜想2.
| A. | MgCO3与盐酸反应:CO32-+2H+=CO2↑+2H2O | |
| B. | FeBr2与少量的Cl2反应:Fe2++Cl2=Fe3++2Cl- | |
| C. | 镁与醋酸反应 Mg+2H+=Mg2++H2↑ | |
| D. | NaHCO3与NaOH反应:HCO3-+OH-=CO32-+H2O |
| A. | 与Al反应可放出H2的溶液中:Fe2+、Cl-、NO3-、Na+ | |
| B. | 甲基橙呈红色的溶液中:Na+、AlO2-、NO3-、HCO3- | |
| C. | 由水电离出的c(H+)=10-11mol/L的溶液中:Fe3+、Na+、NO3-、CH3COO- | |
| D. | 含大量OH一的溶液中:CO32-、Cl-、F-、K+ |

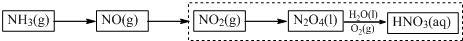

 (g)?3H2(g)+
(g)?3H2(g)+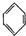 (g)△H1
(g)△H1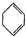 (g)△H2=+28.6KJ/mol
(g)△H2=+28.6KJ/mol