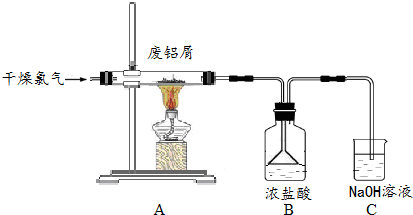
题目内容
20. 某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究.
某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究.【查阅资料】25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
【实验探究】向2支均盛有1mL 0.1mol/L MgCl2溶液的试管中分别加入2滴2mol/L NaOH溶液,制得等量Mg(OH)2沉淀.
(1)分别向两支试管中加入不同试剂,记录实验现象如表:
| 试管编号 | 加入试剂 | 实验现象 |
| Ⅰ | 2滴0.1mol/L FeCl3溶液 | ①白色沉淀转化为红褐色沉淀 |
| Ⅱ | 4mL 2 mol/L NH4Cl 溶液 | ②白色沉淀溶解,得无色溶液 |
(3)同学们猜想实验Ⅱ中沉淀溶解的主要原因有两种:
猜想1:NH4+结合Mg(OH)2电离出的OH-,使Mg(OH)2的溶解平衡正向移动.
猜想2:NH4Cl水解出来的H+与Mg(OH)2电离出OH-结合成水,使Mg(OH)2的溶解平衡正向移动.
(4)为验证猜想,同学们取少量相同质量的氢氧化镁盛放在两支试管中,一支试管中加入醋酸铵溶液(pH=7),另一支试管中加入NH4Cl和氨水混合液(pH=8),两者沉淀均溶解.
①实验证明猜想正确的是1(填“1”或“2”).
②验证猜想时,设计实验向氢氧化镁沉淀中加NH4Cl和氨水混合液的理由是做对比分析,pH=8的NH4Cl和氨水混合液中c(H+)很小,可以否定猜想2.
分析 (1)在Mg(OH)2悬浊液中,加0.1mol/L FeCl3溶液,会生成氢氧化铁沉淀;在Mg(OH)2悬浊液中,加2 mol/L NH4Cl 溶液,Mg(OH)2沉淀会溶解;
(2)根据Ksp[Fe(OH)3]计算溶液中c(Fe3+);
(3)铵根离子显酸性,氢离子与氢氧化镁反应;
(4)①醋酸铵为中性,如果醋酸铵能够溶解氢氧化镁固体,则证明猜想1正确;
②NH4Cl和氨水混合液(pH=8)中氢离子浓度很小,据此进行解答.
解答 解:(1)向2支均盛有1mL 0.1mol/L MgCl2溶液的试管中分别加入2滴2mol/L NaOH溶液,制得等量Mg(OH)2沉淀,
在Mg(OH)2悬浊液中,加0.1mol/L FeCl3溶液,会生成氢氧化铁沉淀,白色沉淀转化为红褐色沉淀;在Mg(OH)2悬浊液中,加2 mol/L NH4Cl 溶液,Mg(OH)2沉淀会溶解,形成无色溶解;
故答案为:
| 试管编号 | 加入试剂 | 实验现象 |
| Ⅰ | 白色沉淀转化为红褐色沉淀 | |
| Ⅱ | 白色沉淀溶解,得无色溶液 |
(2)测得试管Ⅰ中所得混合液pH=6,则溶液中c(Fe3+)=$\frac{Ksp}{{c}^{3}(O{H}^{-})}$=$\frac{4.0×1{0}^{-38}}{(1{0}^{-8})^{3}}$=4×10-14mol/L;
故答案为:4×10-14mol/L;
(3)猜想2:在Mg(OH)2悬浊液中,存在沉淀溶解平衡Mg(OH)2(s)?Mg2+(aq)+2OH -(aq),铵根离子显酸性,NH4Cl水解出来的H+与Mg(OH)2电离出OH-结合成水,使Mg(OH)2的溶解平衡正向移动,所以氢氧化镁沉淀溶解;
故答案为:NH4Cl水解出来的H+与Mg(OH)2电离出OH-结合成水,使Mg(OH)2的溶解平衡正向移动;
(4)①已知醋酸铵为中性,在盛有氢氧化镁沉淀的试管中,加入醋酸铵溶液,能够溶解氢氧化镁固体,则证明猜想1正确;
故答案为:1;
②NH4Cl和氨水混合液(pH=8)中氢离子浓度很小,在盛有氢氧化镁沉淀的试管中,加入NH4Cl和氨水混合液,能够溶解氢氧化镁固体,说明Mg(OH)2溶解不是与氢离子发生反应;
故答案为:做对比分析,pH=8的NH4Cl和氨水混合液中c(H+)很小,可以否定猜想2.
点评 本题考查较为综合,侧重于学生的分析能力和实验能力的考查,题目难度中等,注意把握影响沉淀平衡,电离平衡和水解平衡的因素,综合把握相关基本理论知识,注重基础知识的学习.

练习册系列答案
相关题目
9.分子式为C8H16的某烯烃氢化后得到的饱和烃是 ,则该烯烃的结构最多有( )
,则该烯烃的结构最多有( )
 ,则该烯烃的结构最多有( )
,则该烯烃的结构最多有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
10.下列有关实验的描述不正确的是( )
| A. | 钠在空气和氯气中燃烧,火馅皆呈黄色,但生成固体的颜色不同 | |
| B. | 新制饱和氯水和浓硝酸在光照下会有气体产生,其成分中有氧气 | |
| C. | 亚硫酸露置在空气中酸性减弱 | |
| D. | 灼烧NaOH固体时不能使用瓷坩埚,因为瓷坩埚中的SiO2能与NaOH反应 |
5.科学研究表明,当前应用最广泛的化石燃料到本世纪中叶将枯竭,解决此危机的唯一途径是实现燃料和燃烧产物之间的良性循环(如图1).
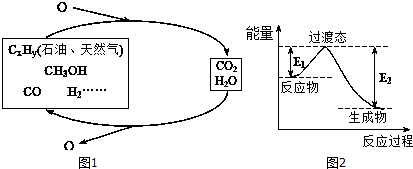
(1)一种常用的方法是在230℃、有催化剂条件下将CO2和H2转化为甲醇蒸汽和水蒸气.图2是生成1molCH3OH时的能量变化示意图.已知破坏1mol不同共价键的能量(kJ)分别是:
已知E1=8.2kJ•mol-1,则E2=198.8kJ•mol-1.
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①该反应的△H<0(填“<”或“>”).
②实验2条件下的平衡常数K=1.
③实验3中,若平衡时H2O的转化率为$\frac{1}{3}$,则$\frac{a}{b}$=0.5,c=$\frac{b}{3}$.
④实验4,若900℃时,在容器中加入CO、H2O、CO2、H2各1mol,则此时V正=V逆(填“<”,“>”,“=”).
(3)捕捉CO2可以利用Na2CO3溶液,先用Na2CO3溶液吸收CO2生成NaHCO3,然后使NaHCO3分解,Na2CO3可以进行循环使用.将100mL0.1mol/LNa2CO3的溶液中通入112mL(已换算为标准状况)的CO2,溶液中没有晶体析出,则:
①反应后溶液中的各离子浓度由大到小的顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
②反应后的溶液可以作“缓冲液”(当往溶液中加入一定量的酸和碱时,有阻碍溶液pH变化的作用),请解释其原理如果向反应后的溶液中加入少量的酸时,碳酸根结合氢离子转化为碳酸氢根,溶液的PH变化不大,如果加入少量的碱时,碳酸氢根结合氢氧根转化为碳酸根,溶液的PH变化也不大,因此反应后溶液可以作缓冲液.

(1)一种常用的方法是在230℃、有催化剂条件下将CO2和H2转化为甲醇蒸汽和水蒸气.图2是生成1molCH3OH时的能量变化示意图.已知破坏1mol不同共价键的能量(kJ)分别是:
| C-H | C-O | C=O | H-H | H-O |
| 413.4 | 351 | 745 | 436 | 462.8 |
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验 | 温度/℃ | 起始量 | 达到平衡 | |||
| CO/mol | H2O/mol | H2/mol | CO转化率 | 所需时间/min | ||
| 1 | 650 | 4 | 2 | 1.6 | 6 | |
| 2 | 900 | 2 | 1 | 1/3 | 3 | |
| 3 | 900 | a | b | c | t | |
②实验2条件下的平衡常数K=1.
③实验3中,若平衡时H2O的转化率为$\frac{1}{3}$,则$\frac{a}{b}$=0.5,c=$\frac{b}{3}$.
④实验4,若900℃时,在容器中加入CO、H2O、CO2、H2各1mol,则此时V正=V逆(填“<”,“>”,“=”).
(3)捕捉CO2可以利用Na2CO3溶液,先用Na2CO3溶液吸收CO2生成NaHCO3,然后使NaHCO3分解,Na2CO3可以进行循环使用.将100mL0.1mol/LNa2CO3的溶液中通入112mL(已换算为标准状况)的CO2,溶液中没有晶体析出,则:
①反应后溶液中的各离子浓度由大到小的顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
②反应后的溶液可以作“缓冲液”(当往溶液中加入一定量的酸和碱时,有阻碍溶液pH变化的作用),请解释其原理如果向反应后的溶液中加入少量的酸时,碳酸根结合氢离子转化为碳酸氢根,溶液的PH变化不大,如果加入少量的碱时,碳酸氢根结合氢氧根转化为碳酸根,溶液的PH变化也不大,因此反应后溶液可以作缓冲液.
12.下列各组中的离子,能在溶液中大量共存的是( )
| A. | K+、NH4+、NO3-、OH- | B. | Ag+、K+、SO42-、Cl- | ||
| C. | H+、Na+、OH-、Cl- | D. | Ca2+、Na+、NO3-、Cl- |
9.金属材料在日常生活以及生产中有有广泛的应用.下列关于金属的一些说法不正确的是( )
| A. | 工业上金属Mg、Cu都是用热还原法制得的 | |
| B. | 合金的性质与其成分金属的性质不完全相同 | |
| C. | 金属冶炼的本质是金属阳离子得到电子变成金属原子 | |
| D. | 越活泼的金属越难冶炼 |
10.关于晶体的叙述中,正确的是( )
| A. | 分子晶体中,分子间的作用力越大,该分子越稳定 | |
| B. | 分子晶体中,共价键的键能越大,熔、沸点越高 | |
| C. | 原子晶体中,共价键的键能越大,熔、沸点越高 | |
| D. | 某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体 |