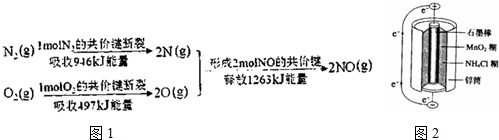
题目内容
3.氨气及其相关产品是基本化工原料,在化工领域中具有重要的作用.(1)以铁为催化剂,0.6mol氮气和1.8mol氢气在恒温、容积恒定为1L的密闭容器中反应生成氨气,20min后达到平衡,氮气的物质的量为0.3mol.
①在第25min时,保持温度不变,将容器体积迅速增大至2L并保持恒容,体系达到平衡时N2的总转化率为38.2%,请画出从第25min起H2的物质的量浓度随时间变化的曲线.

②该反应体系未达到平衡时,催化剂对逆反应速率的影响是增大(填增大、减少或不变).
(2)①N2H4是一种高能燃料,有强还原性,可通过NH3和NaClO反应制得,写出该制备反应的化学方程式NaClO+2NH3=N2H4+NaCl+H2O
②N2H4的水溶液呈弱碱性,室温下其电离常数K1=1.0×10-6,则0.01mol•L-1 N2H4水溶液的pH等于10(忽略N2H4的二级电离和H2O的电离).
③已知298K和101KPa条件下:
N2(g)+3H2(g)=2NH3(g)△H1
2H2(g)+O2(g)=2H2O(l)△H2
2H2(g)+O2(g)=2H2O(g)△H3
4NH3(g)+O2(g)=2N2H4(l)+2H2O(I)△H4
则N2H4(l)的标准燃烧热△H=$\frac{3}{2}$△H2-△H1-$\frac{1}{2}$△H4
(3)科学家改进了NO2转化为HNO3的工艺(如虚框所示),在较高的操作压力下,提高N2O4/H2O的质量比和O2的用量,能制备出高浓度的硝酸.
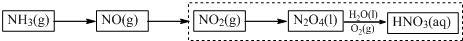
实际操作中,应控制N2O4/H2O质量比高于5.11,对此请给出合理解释2N2O4+2H2O+O2=4HNO3,中N2O4/H2O的质量比等于5.11,高于5.11是为了提高了N2O4的浓度,有利于平衡向正方向移动,得到高浓度的硝酸

分析 (1)①利用三段式求出2min平衡时氢气的物质的量,体积变为2L,则浓度为原来的一半,再根据平衡转化率求出第二次平衡时氢气的浓度;
②催化剂能增大反应速率;
(2)①NaClO溶液和NH3发生氧化还原反应生成氯化钠和肼,根据反应物和生成物写出反应方程式;
②电离方程式为N2H4+H2O?N2H5++OH-,根据K=$\frac{c({N}_{2}{{H}_{5}}^{+})c(O{H}^{-})}{c({N}_{2}{H}_{4})}$计算;
③依据盖斯定律,结合题干中已知热化学方程式计算N2H4(l)+O2(g)=N2(g)+2H2O(l)的反应热;
(3)2N2O4+2H2O+O2=4HNO3,反应中N2O4/H2O的质量比等于5.11,高于5.11,则提高了N2O4的浓度,根据浓度对化学平衡移动的影响分析.
解答 解:(1)①0.6mo1氮气和1.8mo1氢气在恒温、容积恒定为1L的密闭容器中反应生成氨气,2min后达到平衡,氮气的物质的量为0.3mo1
N2(g)+3H2(g)=2NH3(g)
起始(mol):0.6 1.8 0
转化(mol):0.3 0.9 0.6
平衡(mol):0.3 0.9 0.6
在第25min时,保持温度不变,将容器体积迅速增大至2L并保持恒容,则此时c(H2)=$\frac{0.9mol}{2L}$=0.45mol/L;
体系达到平衡时N2的总转化率为38.2%,则转化的氮气为0.6mol×38.2%=0.2292mol;
N2(g)+3H2(g)=2NH3(g)
起始(mol):0.6 1.8 0
转化(mol):0.23 0.69 0.46
平衡(mol):0.37 1.11 0.46
所以第二次平衡时c(H2)=$\frac{1.11mol}{2L}$=0.555mol/L,
则第25min起H2的物质的量浓度为0.45mol/L,平衡时为0.555mol/L,所以图象为 ;
;
故答案为: ;
;
②催化剂能增大反应速率,所以该反应体系未达到平衡时,催化剂对逆反应速率的影响是增大;
故答案为:增大;
(2)①该反应中,次氯酸钠被氨气含有生成氯化钠,氨气被氧化生成肼,同时还有水生成,所以该反应方程式为:NaClO+2NH3=N2H4+NaCl+H2O;
故答案为:NaClO+2NH3=N2H4+NaCl+H2O;
②电离方程式为N2H4+H2O?N2H5++OH-,室温下其电离常数K1≈1.0×10-6,则0.01mol•L-1N2H4水溶液中c(N2H5+)≈c(OH-),
K=$\frac{c({N}_{2}{{H}_{5}}^{+})c(O{H}^{-})}{c({N}_{2}{H}_{4})}$=$\frac{{c}^{2}(O{H}^{-})}{0.01}$=1.0×10-6,所以c(OH-)=10-4mol/L,则c(H+)=10-10mol/L,则溶液的pH=10;
故答案为:10;
③已知:N2(g)+3H2(g)=2NH3(g)△H1
2H2(g)+O2(g)=2H2O(l)△H2
2H2(g)+O2(g)=2H2O(g)△H3
4NH3(g)+O2(g)=2N2H4(l)+2H2O(l)△H4
由盖斯定律可知,N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=$\frac{3}{2}$△H2-△H1-$\frac{1}{2}$△H4;
故答案为:$\frac{3}{2}$△H2-△H1-$\frac{1}{2}$△H4;
(3)由NO2转化为HNO3的工艺图可知,N2O4与水、氧气反应生成硝酸,2N2O4+2H2O+O2=4HNO3,反应中N2O4/H2O的质量比等于5.11,当高于5.11,则提高了N2O4的浓度,有利于平衡向正方向移动,得到高浓度的硝酸;
故答案为:2N2O4+2H2O+O2=4HNO3,中N2O4/H2O的质量比等于5.11,高于5.11是为了提高了N2O4的浓度,有利于平衡向正方向移动,得到高浓度的硝酸.
点评 本题考查了化学平衡的有关计算、电离常数及其计算、盖斯定律的应用、工艺流程图的分析应用等,题目难度中等,侧重于考查学生对基础知识的综合应用能力和计算能力.

| A. | 向CuSO4溶液中加入钠:2Na+Cu2+=Cu+2Na+ | |
| B. | 向Ba(OH)2溶液中滴加稀盐酸:2H++2Cl-+Ba2++2OH-=2H2O+BaCl2 | |
| C. | 澄清石灰水与盐酸反应:H++OH-=H2O | |
| D. | Na2O2与水发生反应:2O22-+2 H2O=4 OH-+O2↑ |
| A. | 钠在空气和氯气中燃烧,火馅皆呈黄色,但生成固体的颜色不同 | |
| B. | 新制饱和氯水和浓硝酸在光照下会有气体产生,其成分中有氧气 | |
| C. | 亚硫酸露置在空气中酸性减弱 | |
| D. | 灼烧NaOH固体时不能使用瓷坩埚,因为瓷坩埚中的SiO2能与NaOH反应 |
| A. | K+、NH4+、NO3-、OH- | B. | Ag+、K+、SO42-、Cl- | ||
| C. | H+、Na+、OH-、Cl- | D. | Ca2+、Na+、NO3-、Cl- |
| A. | vA=0.15mol•L-1•min-1 | B. | vB=0.6mol•L-1•min-1 | ||
| C. | vC=0.4mol•L-1•min-1 | D. | vD=0.01mol•L-1•s-1 |