题目内容
2.下列说法中,不正确的是( )| A. | 管道施工中,不能将铁制自来水管与铜制水龙头连接 | |
| B. | 化学反应过程中,一定有物质的变化,不一定有能量的变化 | |
| C. | 在配制的硫酸亚铁溶液中常加入一定量的铁粉和硫酸 | |
| D. | 已知C(石墨,s)═C(金刚石,s )△H>0,则石墨比金刚石稳定 |
分析 A、Fe、Cu和水构成原电池,Fe易失电子作负极,Cu作正极,负极金属加速被腐蚀;
B、物质发生化学反应的同时,伴随着能量变化;
C、亚铁离子易被氧化且易水解导致溶液呈酸性;
D、石墨完全转化为金刚石时,要吸收能量,说明金刚石能量高于石墨,能量越低越稳定.
解答 解:A、Fe、Cu和水构成原电池,Fe易失电子作负极,Cu作正极,负极金属Fe加速被腐蚀,所以不能将铁制自来水管与铜制水龙头连接,故A正确;
B、物质发生化学反应的同时,伴随着能量变化,故B错误;
C、亚铁离子易被氧化生成铁离子,亚铁离子易水解导致溶液呈酸性,所以为防止亚铁离子被氧化、水解,在配制的硫酸亚铁溶液常加入一定量的铁粉和硫酸,故C正确;
D、石墨完全转化为金刚石时,要吸收能量,说明金刚石能量高于石墨,能量越低越稳定,所以石墨比金刚石稳定,故D正确.
故选B.
点评 本题考查了电化学腐蚀的原理、盐类水解、化学反应与能量等知识点,明确物质的性质是解本题关键,题目难度不大.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
12.下列物质中属于电解质且能导电的是( )
| A. | 硫酸 | B. | 氯化钠溶液 | C. | 熔融氢氧化钠 | D. | 蔗糖固体 |
13.下列说法正确的是( )
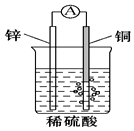

| A. | 构成原电池的两个电极必须是活泼性不同的两种金属 | |
| B. | 通过构成原电池,能将反应的化学能全部转化为电能 | |
| C. | 右图原电池中,电池工作时,SO42-移向电池的正极 | |
| D. | 银锌纽扣电池的放电反应:Zn+Ag2O+H2O═Zn(OH)2+2Ag,其中Ag2O作正极,发生还原反应 |
10.当光束通过下列分散系时,可能产生丁达尔效应的是( )
| A. | NaCl溶液 | B. | Fe(OH)3胶体 | C. | 盐酸 | D. | CuSO4溶液 |
17.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 1 L 0.5 mol•L-1的Fe2(SO4)3 溶液中Fe3+的数目为NA | |
| B. | 室温下,pH=13的NaOH溶液中,OH-离子数目为0.1NA | |
| C. | 0.1 L 0.5 mol•L-1 CH3COOH溶液中含有的氢离子数目小于0.05NA | |
| D. | 电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64 g |
14.某溶液中可能含有Na+、I-、K+、Fe 2+、NH4+、Cu2+、SO32-、SO42-且所有 离子物质的量浓度相等.向该无色溶液中加入少量溴水,溶液仍呈无色,则下列判断正确的是( )
| A. | 肯定不含I- | B. | 肯定不含NH4+ | C. | 可能含有SO32- | D. | 肯定不含SO42- |
10.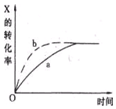 下图曲线a表示放热反应X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系,若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
下图曲线a表示放热反应X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系,若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
 下图曲线a表示放热反应X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系,若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
下图曲线a表示放热反应X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系,若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )| A. | 减压 | B. | 加大X的投入量 | C. | 升高温度 | D. | 减小体积 |
11.在密闭容器中发生下列反应 aA(g)?cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.7倍,下列叙述正确的是( )
| A. | A的转化率变小 | B. | 平衡向正反应方向移动 | ||
| C. | D的物质的量变多 | D. | a>c+d |
 判断如图装置的名称:B池为电解池(填“原电池”或“电解池”)当C2极析出224mL气体(标准状况)时:锌的质量减少(填“增加”或“减少”).
判断如图装置的名称:B池为电解池(填“原电池”或“电解池”)当C2极析出224mL气体(标准状况)时:锌的质量减少(填“增加”或“减少”).