题目内容
17. 化学反应N2(g)+3H2(g)=2NH3(g)的能量变化如图所示,请回答下列问题:
化学反应N2(g)+3H2(g)=2NH3(g)的能量变化如图所示,请回答下列问题:(1)图中A、C分别表示反应物总能量、生成物总能量,反应:放出(填“吸收”或“放出”)能量.
(2)反应过程中断裂的化学键为N≡N键、H-H键,吸收(填“吸收”或“放出”)能量;形成的化学键为N-H键,能量放出(填“吸收”或“放出”).
(3)E2=C-A或E1-E3(用A、C或E1、E3表示).
分析 由能量变化图可知,反应物总能量大于生成物总能量,正反应为放热反应,反应热E2=C-A或E1-E3,以此解答该题.
解答 解:(1)图中A、C分别表示反应物总能量、生成物总能量,反应物总能量大于生成物总能量,正反应为放热反应,故答案为:反应物总能量;生成物总能量;放出;
(2)反应时,断裂N≡N键、H-H键,吸收能量,形成N-H键,放出能量,故答案为:N≡N键、H-H键;吸收;N-H键;放出;
(3)正反应为放热反应,反应热E2=C-A或E1-E3,故答案为:C-A;E1-E3.
点评 本题通过图象考查放热反应的能量变化,为高频考点,侧重于学生的分析能力的考查,注意物质的状态变化时的能量变化,题目难度不大.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
7.pmolC2H4在密闭容器中加强热分解,达到平衡时生成mmolC2H2和nmolH2,将平衡混合气体完全燃烧生成水和二氧化碳,要消耗氧气( )
| A. | ($\frac{3m}{2}$+$\frac{n}{2}$+2p)mol | B. | (3p-$\frac{3m}{2}$-$\frac{n}{2}$)mol | C. | 3pmol | D. | ($\frac{3m}{2}$+$\frac{n}{2}$)mol |
8.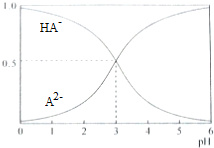 室温下,1mol/L的某二元酸H2A溶液中,可能存在的含A粒子(H2A,HA-,A2-)的物质的量分数(x)随pH变化的关系下图所示,下列说法正确的是( )
室温下,1mol/L的某二元酸H2A溶液中,可能存在的含A粒子(H2A,HA-,A2-)的物质的量分数(x)随pH变化的关系下图所示,下列说法正确的是( )
 室温下,1mol/L的某二元酸H2A溶液中,可能存在的含A粒子(H2A,HA-,A2-)的物质的量分数(x)随pH变化的关系下图所示,下列说法正确的是( )
室温下,1mol/L的某二元酸H2A溶液中,可能存在的含A粒子(H2A,HA-,A2-)的物质的量分数(x)随pH变化的关系下图所示,下列说法正确的是( )| A. | H2A的电离方程式为H2A?H+HA- | |
| B. | 将pH=2的NaHA和Na2A混合溶液中加水稀释10倍,溶液的pH=3 | |
| C. | 将相同物质的量的NaHA和Na2A固体溶于水所得混合溶液的pH一定为3 | |
| D. | Na2A溶液存在:c(0H-)=c(H+)+c(HA-) |
2.下列装置能达到实验目的是( )
| A. |  检验产物中含有乙烯 | B. |  除去CO中混有少量的CO2 | ||
| C. |  验证减压蒸馏原理 | D. |  收集NH3 |
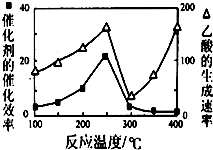 利用CH4和CO2可以制造价值更高的化学产品.已知下列反应:
利用CH4和CO2可以制造价值更高的化学产品.已知下列反应: .
.
 .
. 实验室需要0.1mol/L NaOH溶液900mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/L NaOH溶液900mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.