题目内容
6.W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比7:17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;Z的原子序数是X和Y的原子序数之和的一半.请回答下列问题:
(1)画出X的原子结构示意图:
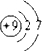 .
.(2)从原子结构分析,Y和Z具有相同的电子层数.
(3)Y的最高价氧化物属于两性(填“碱性”“酸性”或“两性”)氧化物,写出该氧化物与烧碱反应的化学方程式:Al2O3+2NaOH═2NaAlO2+H2O.
分析 W的最外层电子数与核外电子总数之比为7:17,且W是短周期元素,原子序数小于18,所以W是Cl元素;X与W同主族,且X为短周期元素,所以X是F元素;Y的原子序数是W和X的原子序数之和的一半,则Y的原子序数为$\frac{1}{2}$(17+9)=13,则Y为Al元素;Z的原子序数是X和Y的原子序数之和的一半,Z的原子序数为$\frac{1}{2}$(9+13)=11,为Na元素,以此解答该题.
解答 解:W的最外层电子数与核外电子总数之比为7:17,且W是短周期元素,原子序数小于18,所以W是Cl元素;X与W同主族,且X为短周期元素,所以X是F元素;Y的原子序数是W和X的原子序数之和的一半,则Y的原子序数为:$\frac{1}{2}$(17+9)=13,则Y为Al元素;Z的原子序数是X和Y的原子序数之和的一半,Z的原子序数为$\frac{1}{2}$(9+13)=11,为Na元素,
(1)X是F元素,原子核外有2个电子层,最外层电子数为7,原子结构示意图为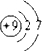 ,故答案为:
,故答案为: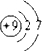 ;
;
(2)Y为Al,Z为Na,原子核外都有3个电子层,位于同一周期,故答案为:电子层数;
(3)Y为Al,最高价氧化物为氧化铝,属于两性氧化物,可与碱、酸反应生成盐和水,氧化铝与氢氧化钠反应的化学方程式为Al2O3+2NaOH═2NaAlO2+H2O,
故答案为:两性;Al2O3+2NaOH═2NaAlO2+H2O.
点评 本题考查了位置、结构与性质关系的应用,题目难度中等,正确推断各元素名称为解答关键,注意掌握原子结构与元素周期表、元素周期律的关系,试题侧重基础知识的考查,培养了学生的分析、理解能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.下列各说法正确的是( )
| A. | 对于2SO2(g)+O2(g)?2SO3(g)△H=-QkJ/mol(Q>0),若向一密闭容器中加入1molSO2和0.5molO2充分反应后,放出的热量为0.5QkJ | |
| B. | 热化学方程式中的化学计量数表示相应物质的物质的量,不能用分数表示 | |
| C. | 需要加热才能发生的反应不一定是吸热反应 | |
| D. | 小苏打在水中的电离方程式:NaHCO3═Na++H++CO${\;}_{3}^{2-}$ |
14.下列说法正确的是( )
| A. | 铝制品的耐腐蚀性强,说明铝的化学性质不活泼 | |
| B. | 化学反应速率的单位由时间单位和物质的量单位决定 | |
| C. | 离子键的本质是静电作用,只能存在于由阴,阳离子构成的物质中 | |
| D. | 可将金属钠在研体中研成粉末,使钠与水反应的实验更安全 |
11.W是由短周期元素X、Y、Z组成的盐.X、Y、Z原子的最外层电子数依次增大,Z原子最外层电子数是内层电子数的3倍;X、Y原子最外层电子数之和等于Z原子的最外层电子数;Y、Z同周期且相邻,但与X不同周期.下列说法一定正确的是( )
| A. | 三种元素的最高正化合价中,Z的最大 | |
| B. | W溶液显碱性或中性 | |
| C. | 原子半径:X>Y>Z | |
| D. | Y的最高价氧化物对应的水化物是强酸. |
4.已知25℃时有关弱酸的电离平衡常数:则下列有关说法正确的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
| A. | 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| B. | a mol•L-1 HCN溶液与b mol•L-1 NaOH溶液等体积混合后,若所得溶液中c(Na+)>c(CN-),则a可能大于b | |
| C. | 冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度均先增大后减小 | |
| D. | NaHCO3溶液中,一定存在c(Na+)=c(HCO3-)+2c(CO32-)+c(H2CO3) |
 化学反应N2(g)+3H2(g)=2NH3(g)的能量变化如图所示,请回答下列问题:
化学反应N2(g)+3H2(g)=2NH3(g)的能量变化如图所示,请回答下列问题:

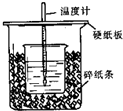 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: