题目内容
7.pmolC2H4在密闭容器中加强热分解,达到平衡时生成mmolC2H2和nmolH2,将平衡混合气体完全燃烧生成水和二氧化碳,要消耗氧气( )| A. | ($\frac{3m}{2}$+$\frac{n}{2}$+2p)mol | B. | (3p-$\frac{3m}{2}$-$\frac{n}{2}$)mol | C. | 3pmol | D. | ($\frac{3m}{2}$+$\frac{n}{2}$)mol |
分析 根据原子守恒可知,反应后混合气体的耗氧量即是p molC2H4燃烧的耗氧量,反应物为CO2和H2O,根据C原子、H原子守恒计算出CO2和H2O的物质的量,再根据O原子守恒计算消耗的氧气物质的量.
解答 解:反应前后C原子和H原子的物质的量没有发生变化,则混合气体的耗氧量即是p molC2H4的耗氧量,根据碳原子守恒n(CO2)=2n(C2H4)=2p mol,根据H原子守恒n(H2O)=2n(C2H4)=2p mol,
根据O原子守恒,则2n(O2)=2n(CO2)+n(H2O)=4p mol+2p mol=6p mol,
则消耗的氧气的物质的量n(O2)=3p mol,
故选C.
点评 本题考查混合物的计算,题目难度不大,关键清楚反应后混合气体的耗氧量即是p molC2H4燃烧的耗氧量.

练习册系列答案
相关题目
17.下列热化学方程式中的反应热(括号内)表示燃烧热的是( )
| A. | NH3(g)+$\frac{5}{4}$O2(g)═NO(g)+$\frac{6}{4}$H2O(g);△H=-akJ•mol-1 | |
| B. | C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l);△H=-bkJ•mol-1 | |
| C. | 2CO(g)+O2(g)═2CO2(g);△H=-ckJ•mol-1 | |
| D. | CH3CH2OH(l)+$\frac{1}{2}$O2(g)═CH3CHO(l)+H2O(l);△H=-dkJ•mol-1 |
15.下列混合物的分离方法不可行的是( )
| A. | 互溶的液态混合物可用分液的方法分离 | |
| B. | 互不相溶的液态混合物可用分液的方法分离 | |
| C. | 沸点不同的液态混合物可用蒸馏的方法分离 | |
| D. | 氯化钠和氧化铜形成的混合物可以按溶解、过滤、蒸发的顺序分离 |
2.常温下,某溶液 A 中含有 NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、Cl-、SO42-、SO32-,现取该溶液进行有关实验,实验结果如图所示
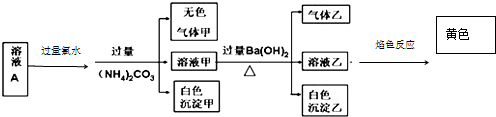
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 沉淀乙一定可溶于盐酸 | |
| B. | 溶液中一定存在 Na+、Al3+,一定没有 Fe3+、Fe2+、CO32- | |
| C. | 溶液中一定有 SO42-,可能有 K+、Cl- | |
| D. | 气体甲、乙均为无色、有刺激性气味 |
12.下列反应过程中的能量变化情况符合图的是( )


| A. | 酸与碱的中和反应 | B. | 石灰石高温分解反应 | ||
| C. | 镁和盐酸的反应 | D. | 氧化钙和水的反应 |
19.下列属于取代反应的是( )
| A. | 甲烷的燃烧 | |
| B. | 乙烯通入溴水中 | |
| C. | 在镍做催化剂的条件下,苯与氢气反应 | |
| D. | 苯与液溴混合后撒入铁粉 |
16.下列各说法正确的是( )
| A. | 对于2SO2(g)+O2(g)?2SO3(g)△H=-QkJ/mol(Q>0),若向一密闭容器中加入1molSO2和0.5molO2充分反应后,放出的热量为0.5QkJ | |
| B. | 热化学方程式中的化学计量数表示相应物质的物质的量,不能用分数表示 | |
| C. | 需要加热才能发生的反应不一定是吸热反应 | |
| D. | 小苏打在水中的电离方程式:NaHCO3═Na++H++CO${\;}_{3}^{2-}$ |
 化学反应N2(g)+3H2(g)=2NH3(g)的能量变化如图所示,请回答下列问题:
化学反应N2(g)+3H2(g)=2NH3(g)的能量变化如图所示,请回答下列问题: