题目内容
3.在同温同压下,两个体积相同的玻璃密闭容器中分别盛满氮气和氧气,则容器中氮气和氧气的物质的量之比为1:1,质量之比为7:8.分析 同温同压下气体的气体摩尔体积相等,根据n=$\frac{V}{Vm}$=$\frac{m}{M}$进行计算回答.
解答 解:同温同压下气体的气体摩尔体积Vm相等,根据n=$\frac{V}{Vm}$,体积相同的氮气和氧气的物质的量之比等于1:1,
据n=$\frac{m}{M}$,质量之比等于摩尔质量之比,即:28:32=7:8,
故答案为:1:1;7:8.
点评 本题考查物质的量的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握相关物理量与计算公式的运用,难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
13.液氨与水的电离相似,存在微弱的电离:2NH3+NH3NH4++NH2-.对该体系的说法中错误的是( )
| A. | 液氨中c(NH4+)与c(NH2-)的乘积为一常数 | |
| B. | 液氨电离达到平衡时,各微粒的浓度保持不变 | |
| C. | 只要不加入其它物质c(NH4+)=c(NH2-) | |
| D. | 液氨中存在NH3、NH4+、NH2-、H2O、NH3•H2O等粒子 |
14.下列关于元素周期表和周期律说法中,正确的是( )
| A. | 周期表中,元素所在的族序数等于原子的最外层电子数 | |
| B. | 同主族元素,随原子序数的增大,原子半径增大,主要原因是核电荷数增大 | |
| C. | 第二周期元素随原子序数的递增,元素原子的第一电离能依次递增 | |
| D. | 第 VIIA族元素从上到下,元素电负性逐渐减小 |
18.下列离子方程式正确的是( )
| A. | 硫酸铜溶液与足量氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| B. | 用醋酸除水垢:2CH3COOH+CaCO3═2CH3COO-+Ca2++H2O+CO2↑ | |
| C. | 硫化钠的水解反应:S2-+H3O+?HS-+H2O | |
| D. | 用K37ClO3与浓盐酸制氯气:37ClO3-+6H++6Cl-═37Cl-+3Cl2↑+3H2O |
12.下列说法不正确的是( )
| A. | 定容时,因不慎使液面高于容量的刻度线,需重新配制 | |
| B. | 焰色反应时,先用稀盐酸洗涤铂丝并在酒精灯火焰上灼烧至无色,然后进行实验 | |
| C. | 将新制氯水滴入紫色石蕊溶液中,可以看到石蕊溶液先变红后褪色 | |
| D. | 取少量晶体放入试管中,加入适量稀NaOH溶液,在试管口用湿润的红色石蕊试纸检验,若试纸变蓝,则可证明该晶体中含有NH4+ |

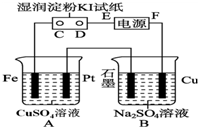 用如图所示的装置进行电解.通电一会儿,发现用NaCl溶液湿润的淀粉KI试纸的C端变为蓝色.
用如图所示的装置进行电解.通电一会儿,发现用NaCl溶液湿润的淀粉KI试纸的C端变为蓝色.