题目内容
8.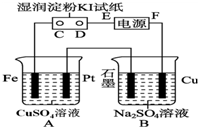 用如图所示的装置进行电解.通电一会儿,发现用NaCl溶液湿润的淀粉KI试纸的C端变为蓝色.
用如图所示的装置进行电解.通电一会儿,发现用NaCl溶液湿润的淀粉KI试纸的C端变为蓝色.(1)E为电源的负极,Fe为阴极
(2)A中发生反应的离子方程式为2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+4H++O2↑,B中发生反应的化学方程式为2Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu(OH)2+H2↑
(3)在B中观察到的现象是铜片溶解,石墨电极上有气体生成,溶液中有蓝色沉淀生成
(4)若此电源为铅蓄电池,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$PbSO4+2H2O,则放电时:正极的电极反应式是PbO2+2e-+4H++2SO42-=PbSO4+2H2O;电解液中H2SO4的浓度将变小;当外电路通过1mol电子时,理论上负极板的质量增加48g,此时若要使A池中的溶液复原,应加入40g的CuO固体.
分析 通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色,说明C端是阳极,则E是负极,F是正极,铁作阴极,铂丝作阳极,电解硫酸铜溶液时,阴极上铜离子放电,阳极上氢氧根离子放电,
(1)E为电源的 负极,铁电源负极相连,所以Fe为阴极;
(2)A池中为惰性电极电解硫酸铜溶液,反应的离子方程式为2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+4H++O2↑;B中铜为阳极电解硫酸钠溶液,发生反应的化学方程式为2Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu(OH)2+H2↑;
(3)在B中观察到的现象是铜片溶解,石墨电极上有气体生成,溶液中有蓝色沉淀生成;
(4)电池总反应式为:Pb+PbO2+4H++2SO42-?2PbSO4+2H2O,写出电极反应为:负极电解反应:Pb-2e-+SO42-=PbSO4 ,正极电极反应:PbO2+2e-+4H++2SO42-=PbSO4+2H2O,依据电解反应和电池原理分析判断.
解答 解:通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色,说明C端是阳极,则E是负极,F是正极,铁作阴极,铂丝作阳极,电解硫酸铜溶液时,阴极上铜离子放电,阳极上氢氧根离子放电,
(1)E为电源的 负极,铁电源负极相连,所以Fe为阴极,故答案为:负;阴;
(2)A池中为惰性电极电解硫酸铜溶液,反应的离子方程式为2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+4H++O2↑;B中铜为阳极电解硫酸钠溶液,发生反应的化学方程式为2Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu(OH)2+H2↑;故答案为:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+4H++O2↑;2Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu(OH)2+H2↑;
(3)在B中观察到的现象是铜片溶解,石墨电极上有气体生成,溶液中有蓝色沉淀生成,故答案为:铜片溶解,石墨电极上有气体生成,溶液中有蓝色沉淀生成;
(4)电池总反应式为:Pb+PbO2+4H++2SO42-?2PbSO4+2H2O,写出电极反应为:负极电解反应:Pb-2e-+SO42-=PbSO4 ,正极电极反应:PbO2+2e-+4H++2SO42-=PbSO4+2H2O,放电时:正极的电极反应式是PbO2+2e-+4H++2SO42-=PbSO4+2H2O;电解液中H2SO4的浓度将减少;当外电路通过1mol电子时,依据电子守恒计算理论上负极板的质量增加0.5mol×303g/mol-0.5mol×207g/mol=48g,此时若要使A池中的溶液复原,应加入0.5molCuO固体,其质量为0.5mol×80g/mol=40g,
故答案为:PbO2+2e-+4H++2SO42-=PbSO4+2H2O;小;48;40.
点评 本题综合考查电解原理,侧重于考查学生综合运用电解知识的能力,题目难度较大,注意把握电解规律,能正确判断电极方程式.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案| A. | 28 g氮气所含有的原子数目为NA | |
| B. | 在常温常压下,11.2 L N2含有的分子数为0.5 NA | |
| C. | 0.5 mol单质铁与足量盐酸反应转移电子数为NA | |
| D. | 标准状况下,1 L水所含分子数为$\frac{1}{22.4}$NA |
| A. | 所有自发进行的化学反应都是放热反应 | |
| B. | 高温高压下可以使石墨转化为金刚石是自发的化学反应 | |
| C. | 由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程 | |
| D. | 同一物质的固、液、气三种状态的熵值相同 |

| A. | O→a时的反应的离子方程式为:Ba2++2OH-+SO42-+2H+═BaSO4↓+2 H2O | |
| B. | a→b时发生的离子反应为H++OH-═H2O | |
| C. | 原混合溶液中 C(HCl):C(MgSO4)=3:1 | |
| D. | 从a→b→c说明溶液中结合OH-的能力强弱为:H+>Mg2+ |

