题目内容
18.下列离子方程式正确的是( )| A. | 硫酸铜溶液与足量氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| B. | 用醋酸除水垢:2CH3COOH+CaCO3═2CH3COO-+Ca2++H2O+CO2↑ | |
| C. | 硫化钠的水解反应:S2-+H3O+?HS-+H2O | |
| D. | 用K37ClO3与浓盐酸制氯气:37ClO3-+6H++6Cl-═37Cl-+3Cl2↑+3H2O |
分析 A.漏写生成氢氧化铜的离子反应;
B.反应生成醋酸钙、水、二氧化碳;
C.硫离子水解分步进行,以第一步为主;
D.K37ClO3作氧化剂.
解答 解:A.硫酸铜溶液与足量氢氧化钡溶液混合的离子反应为Cu2++2OH-+Ba2++SO42-═BaSO4↓+Cu(OH)2↓,故A错误;
B.用醋酸除水垢的离子反应为2CH3COOH+CaCO3═2CH3COO-+Ca2++H2O+CO2↑,故B正确;
C.硫化钠的水解反应的离子反应为S2-+H2O?HS-+OH-,故C错误;
D.用K37ClO3与浓盐酸制氯气的离子反应为237ClO3-+12H++10Cl-═37Cl2↑+5Cl2↑+6H2O,故D错误;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
8.下列叙述正确的是( )
| A. | 将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO42-)>c(NH4+) | |
| B. | 两种醋酸溶液的物质的量浓度分别为c1和c2,pH的别为a和a+1,则c1=10c2 | |
| C. | 常温下,pH=11的NaOH溶液与pH=3的盐酸溶液等体积混合,滴入石蕊溶液呈红色 | |
| D. | 向0.1mol•L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-):c(NH3•H2O)减小 |
9.下列物质中,能够导电的电解质是( )
| A. | Cu丝 | B. | NaCl溶液 | C. | 熔融的NaOH | D. | 蔗糖 |
6.化学与科学、技术、社会、环境密切相关.下列有关说法中正确的是( )
| A. | 高纯度的硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” | |
| B. | 煤经过气化和液化两个物理变化,可变为清洁能源 | |
| C. | 如将材料均匀分散到某液体分散剂中,该分散系可发生丁达尔现象,由此可推测该材料的直径为1~100pm之间 | |
| D. | 屠呦呦女士利用乙醚萃取青蒿素获得了2015年度诺贝尔生理学或医学奖,为人类防治疟疾作出了重大贡献 |
13.关于图中各装置的叙述不正确的是( )
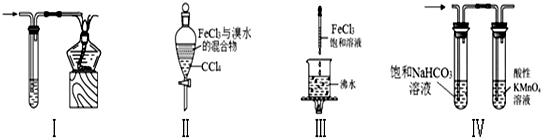

| A. | 装置Ⅰ:可用于处理CO尾气 | |
| B. | 装置Ⅱ:充分振荡后静置,下层溶液为红棕色,上层无色 | |
| C. | 装置Ⅲ:当液体呈红褐色,停止加热,让光束通过体系可产生丁达尔效应 | |
| D. | 装置Ⅳ:可用于除去CO2气体中的HCl和SO2气体 |
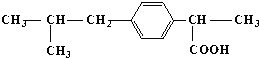
 草酸(H2C2O4)是一种还原性二元酸,存在于菠菜等植物中.已知常温下,草酸的电离常数K1=5.4×10-2,K2=5.4×10-5.溶度积常数:草酸钙Ksp(CaC2O4)=4.0×10-8,Ksp(CaSO4)=7.10×10-9.请回答下列问题:
草酸(H2C2O4)是一种还原性二元酸,存在于菠菜等植物中.已知常温下,草酸的电离常数K1=5.4×10-2,K2=5.4×10-5.溶度积常数:草酸钙Ksp(CaC2O4)=4.0×10-8,Ksp(CaSO4)=7.10×10-9.请回答下列问题: