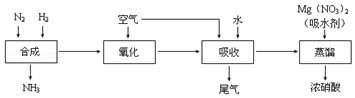
题目内容
20.下列说法正确的是( )| A. | 对CO(g)+H2S(g)?COS(g)+H2(g)达到平衡后,升高温度,H2S浓度增加,表明该反应是吸热反应 | |
| B. | 对CO(g)+H2S(g)?COS(g)+H2(g)达到平衡后,通入CO后,正反应速率逐渐增大 | |
| C. | 一定条件下反应N2+3H2?2NH3达到平衡时,3v正(H2)=2v逆(NH3) | |
| D. | 对于反应CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,只改变压强,平衡不发生移动,反应放出的热量不变 |
分析 A.升高温度平衡向吸热方向移动;
B.增大CO的浓度,正速率瞬间增大;
C.达到平衡时,不同物质的正逆速率之比等于计量数比即是平衡状态;
D.反应前后气体的计量数相同的反应,改变压强平衡不移动.
解答 解:A.升高温度,H2S浓度增加,说明平衡逆向移动,升高温度,平衡向吸热反应方向移动,则该反应是放热反应,故A错误;
B.对CO(g)+H2S(g)?COS(g)+H2(g)达到平衡后,通入CO后,CO的浓度瞬间增大,正速率瞬间增大,然后逐渐减小,故B错误;
C.一定条件下反应N2+3H2?2NH3达到平衡时,2v正(H2)=3v逆(NH3),故C错误;
D.对于反应CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,反应前后气体的计量数相同,只改变压强,平衡不发生移动,反应放出的热量不变,故D正确.
故选D.
点评 本题考查了化学平衡的影响因素、平衡状态的判断,题目难度不大,明确温度、压强、浓度对平衡移动的影响以及平衡状态的判断方法是解题的关键,试题有利于培养学生的分析、理解能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.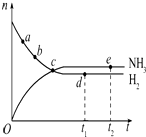 合成氨工业对国民经济和社会发展具有重要的意义,对于密闭容器中的反应:N2(g)+3H2(g) $\stackrel{一定条件}{?}$2NH3(g),在637K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义,对于密闭容器中的反应:N2(g)+3H2(g) $\stackrel{一定条件}{?}$2NH3(g),在637K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
 合成氨工业对国民经济和社会发展具有重要的意义,对于密闭容器中的反应:N2(g)+3H2(g) $\stackrel{一定条件}{?}$2NH3(g),在637K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义,对于密闭容器中的反应:N2(g)+3H2(g) $\stackrel{一定条件}{?}$2NH3(g),在637K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的大 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| D. | 其他条件不变,773 K下反应至t1时刻,n(H2)比图中d点的值大 |
15.已知反应:
①101kPa时,2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1;
②稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
下列结论正确的是( )
①101kPa时,2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1;
②稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
下列结论正确的是( )
| A. | .碳的燃烧热△H=-110.5 kJ•mol-1 | |
| B. | .①的反应热为221 kJ•mol-1 | |
| C. | 浓硫酸与稀NaOH溶液反应生成1 mol水,放出的热量为57.3 kJ | |
| D. | .碳的燃烧热大于110.5 kJ•mol-1 |
5.在恒温恒压下,向密闭容器中充入4mol SO2和2mol O2,发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0.2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量Q kJ,则下列分析正确的是( )
| A. | 在该条件下,反应前后的压强之比为6:5.3 | |
| B. | 若反应开始时容器体积为2 L,则0~2 min内v(SO3)=0.35 mol/(L•min) | |
| C. | 若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol | |
| D. | 若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出的热量大于Q kJ |
9.某兴趣小组欲通过实验方法验证Fe2+的某些性质.
(1)在实验前,依据Fe2+的还原性,填写了如表.
依照表中操作,该小组进行实验.观察到液面上方气体逐渐变为红棕色,但试管中溶液颜色却变为深棕色.
(2)分别取少量反应后的溶液于两只试管中,一只滴加几滴KSCN溶液,溶液变为变红,则溶液中含有Fe3+;另一只试管滴加几滴K3[Fe(CN)6]溶液,产生蓝色沉淀,则含有Fe2+.
(3)该小组讨论认为深棕色可能是NO2或NO与铁的某一种离子发生反应引起的.
提出猜想:
ⅰ.NO2与Fe2+发生反应ⅱ.NO2 与Fe3+发生反应
ⅲ.NO与Fe2+发生反应ⅳ.NO与Fe3+发生反应
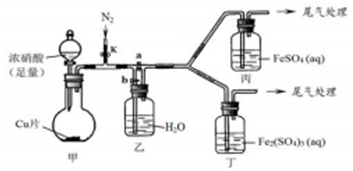
(4)该小组用如图装置进行探究:
(5)结合实验猜想,得出结论:
溶液呈深棕色的原因:肯定成立的是猜想ⅲ;不确定的是猜想i,有待后续实验进一步探究.
(1)在实验前,依据Fe2+的还原性,填写了如表.
| 实验操作 | 预期现象 | 反应的离子方程式 |
| 向盛有新割FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO3-+2H+=Fe3++NO2↑+H2O |
(2)分别取少量反应后的溶液于两只试管中,一只滴加几滴KSCN溶液,溶液变为变红,则溶液中含有Fe3+;另一只试管滴加几滴K3[Fe(CN)6]溶液,产生蓝色沉淀,则含有Fe2+.
(3)该小组讨论认为深棕色可能是NO2或NO与铁的某一种离子发生反应引起的.
提出猜想:
ⅰ.NO2与Fe2+发生反应ⅱ.NO2 与Fe3+发生反应
ⅲ.NO与Fe2+发生反应ⅳ.NO与Fe3+发生反应
(4)该小组用如图装置进行探究:

| 步骤 | 操作及现象 | 解释或结论 |
| ① | 关闭k、b,打开a,开始甲中反应,一段时间后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化 | 溶液深棕色由Fe2+与NO或NO2反应而的得到 |
| ② | 停止甲中反应,打开k、b,关闭a,持续通入N2一段时间 | 该操作的目的排净乙装置及导气管中的NO2 |
| ③ | 更换新的丙、丁装置,再通一段时间N2后关闭k,使甲中反应继续,观察到的现象与步骤①中相同 | 乙瓶中发生的化学反应方程式为3NO2+H2O=2HNO3+NO |
溶液呈深棕色的原因:肯定成立的是猜想ⅲ;不确定的是猜想i,有待后续实验进一步探究.
10.现要配置一定物质的量浓度的100mL1mol•L-1NaOH溶液,下列操作正确的是( )
| A. | 用蒸馏水洗涤烧杯、玻璃棒2~3次,每次洗涤后的溶液都注入容量瓶中 | |
| B. | 把称量的NaOH固体放入盛有适量蒸馏水的烧杯中,溶解后立即把溶液转移到容量瓶中 | |
| C. | 在托盘天平的两个托盘上各放一张大小一样的纸,然后将NaOH固体放在纸上进行称量 | |
| D. | 沿着玻璃棒往容量瓶中加入蒸馏水,直到溶液凹液面恰好与刻度相切 |
 分析图象回答:曲线②NO转化率随温度升高而增大的原因反应没有达到平衡,温度越高反应速率越快,转化率越大.在图2中画出反应2NO(g)+2CO(g)?N2(g)+2CO2(g)在不同温度下达到平衡时c(N2)的变化趋势图.
分析图象回答:曲线②NO转化率随温度升高而增大的原因反应没有达到平衡,温度越高反应速率越快,转化率越大.在图2中画出反应2NO(g)+2CO(g)?N2(g)+2CO2(g)在不同温度下达到平衡时c(N2)的变化趋势图.