题目内容
12.工业合成氨与制备HNO3一般可连续生产,其流程如图: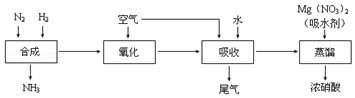
①写出工业合成氨的化学方程式N2+3H2 $\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,上述尾气中的NO一定条件下可与氨气反应转化为氮气,则该反应的化学方程式为6NO+4NH3$\frac{\underline{\;一定条件\;}}{\;}$5N2+6H2O.
②某同学在实验室蒸馏含有Mg(NO3)2的稀硝酸制取浓硝酸,除导管、酒精灯、牛角管、锥形瓶外,还需的玻璃仪器有蒸馏烧瓶、温度计、冷凝管.
分析 ①工业合成氨是氢气和氮气在高温高压催化剂作用下反应生成氨气,NO一定条件下可与氨气反应转化为氮气,结合原子守恒配平书写得到化学方程式;
②依据蒸馏实验过程和实验装置分析需要的玻璃仪器.
解答 解:(1)①工业合成氨是氢气和氮气在高温高压催化剂作用下反应生成氨气,反应的化学方程式为:N2+3H2 $\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,NO一定条件下可与氨气反应转化为氮气,结合原子守恒配平书写得到化学方程式为:6NO+4NH3$\frac{\underline{\;一定条件\;}}{\;}$5N2+6H2O,
故答案为:N2+3H2 $\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,6NO+4NH3$\frac{\underline{\;一定条件\;}}{\;}$5N2+6H2O;
②某同学在实验室蒸馏含有Mg(NO3)2的稀硝酸制取浓硝酸,除导管、酒精灯、牛角管、锥形瓶外,还需的玻璃仪器有:蒸馏烧瓶、温度计、冷凝管;
故答案为:蒸馏烧瓶、温度计、冷凝管.
点评 本题考查了氮氧化物性质的应用,气体实验制备方法等问题,题目难度中等.

练习册系列答案
相关题目
2.下列说法不正确的是( )
| A. | 蛋白质、棉花、PVC、淀粉、涤纶都是由高分子组成的物质 | |
| B. | 乙醇和二甲醚互为同分异构体,利用红外光谱法或核磁共振氢谱法均可鉴别两者 | |
| C. | 雾霾天气的造成与PM2.5指数有着重要的关系,PM2.5是指大气中直径小于或等于2.5pm(皮米)的颗粒物 | |
| D. | 将废动植物油脂经反应改性制成“生物柴油”,代替柴油作为内燃机燃料的做法符合“绿色化学”的理念 |
3.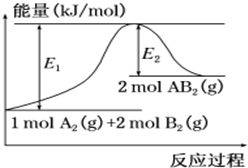 已知某化学反应A2 (g)+2B2 (g)═2AB2(g) (AB2的分子结构为B-A-B)的能量变化如图所示,下列有关叙述中正确的是( )
已知某化学反应A2 (g)+2B2 (g)═2AB2(g) (AB2的分子结构为B-A-B)的能量变化如图所示,下列有关叙述中正确的是( )
 已知某化学反应A2 (g)+2B2 (g)═2AB2(g) (AB2的分子结构为B-A-B)的能量变化如图所示,下列有关叙述中正确的是( )
已知某化学反应A2 (g)+2B2 (g)═2AB2(g) (AB2的分子结构为B-A-B)的能量变化如图所示,下列有关叙述中正确的是( )| A. | 该反应的进行一定需要加热 | |
| B. | 该反应的△H=-(E1-E2)kJ/mol | |
| C. | 该反应中反应物的键能总和大于生成物的键能总和 | |
| D. | 断裂1 mol A-A和2 mol B-B放出E1 kJ能量 |
20.下列说法正确的是( )
| A. | 对CO(g)+H2S(g)?COS(g)+H2(g)达到平衡后,升高温度,H2S浓度增加,表明该反应是吸热反应 | |
| B. | 对CO(g)+H2S(g)?COS(g)+H2(g)达到平衡后,通入CO后,正反应速率逐渐增大 | |
| C. | 一定条件下反应N2+3H2?2NH3达到平衡时,3v正(H2)=2v逆(NH3) | |
| D. | 对于反应CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,只改变压强,平衡不发生移动,反应放出的热量不变 |
7.反应X(g)+Y(g)?2Z(g)△H<0,达到平衡时,下列说法正确的是( )
| A. | 减小容器体积,平衡向右移动 | |
| B. | 加入催化剂,平衡不移动故正逆反应速率不变 | |
| C. | 增大c(X),X的转化率增大 | |
| D. | 降低温度,Y的转化率增大 |
17.在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)?MHx+2y(s)△H<0 达到化学平衡时.下列有关叙述正确的是( )
| A. | 吸收y mol H2只需1 mol MHx | |
| B. | 平衡时容器内气体压强减小 | |
| C. | 若降温,该反应的平衡常数增大 | |
| D. | 若向容器内通入少量氢气,则v(放氢)>v(吸氢) |
4.下列说法正确的是( )
| A. | H2O的摩尔质量是18g | B. | 1mol氧的质量是16g | ||
| C. | 氧气的摩尔质量是32g•mol-1 | D. | 2molH2的摩尔质量是4g |
1.在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图所示,则下列叙述正确的是( )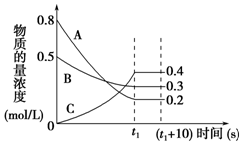

| A. | t1s时反应物A的转化率为60% | |
| B. | 在t1~(t1+10)s时,v(A)=v(B)=0 | |
| C. | 该反应的化学方程式为3A+B?2C | |
| D. | 0~t1s内A的反应速率为v(A)=$\frac{0.2}{{t}_{1}}$mol/(L•s) |
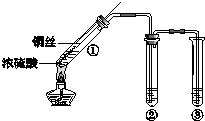 某小组同学探究浓硫酸及其部分反应产物的化学性质,装置如图所示(夹持装置略去).
某小组同学探究浓硫酸及其部分反应产物的化学性质,装置如图所示(夹持装置略去).