题目内容
6.下列说法正确的是( )| A. | 木糖醇( 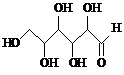 )和葡萄糖( )和葡萄糖(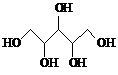 )互为同系物,均 )互为同系物,均属于糖类 | |
| B. | 分子式为C6H14的有机物其一氯代物有三种,此有机物可能是3,3-二甲基丁烷 | |
| C. | 聚乙烯(PE)和聚氯乙烯(PVC)的单体都是不饱和烃,均能使溴水褪色 | |
| D. | 等质量的乙烯、甲醚、碳酸二甲酯(CH3OCOOCH3)完全燃烧耗氧量一定不相同 |
分析 A、结构相似,分子组成上相差CH2原子团的有机物互称为同系物;
B、3,3-二甲基丁烷的命名错误;
C、聚氯乙烯(PVC)的单体都是氯乙烯,属于烃的衍生物,不属于不饱和烃;
D、等质量的乙烯与碳酸甲酯完全燃烧时耗氧量根据分子式的原子构成来判断即可.
解答 解:A、结构相似,分子组成上相差CH2原子团的有机物互称为同系物,A中结构不同,故A错误;
B、3,3-二甲基丁烷的命名错误,故B错误;
C、聚氯乙烯(PVC)的单体都是氯乙烯,属于烃的衍生物,不属于不饱和烃,故C错误;
D、等质量的乙烯(C2H4)、甲醚(CH3OCH3,可改写为C2H4•H2O)和碳酸二甲酯(可以写成:C2H4•CO2•H2O)都是C2H4耗氧,由于摩尔质量三者不相同,故物质的量不等,完全燃烧时耗氧量一定不同,故D正确;
故选D.
点评 本题涉及有机物的同系物、同分异构现象、有机物的结构以及有机物燃烧耗氧量的计算等知识,属于综合知识的考查,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.25℃时,0.1mol•L-1的CH3COONa溶液的pH=a,下列说法正确的是( )
| A. | 该溶液中水电离出的c(H+)=10-8mol/L | |
| B. | 加水稀释,醋酸钠的水解程度增大,水的电离程度也增大 | |
| C. | 加入盐酸,pH=7时,有c(C1-)=c(CH3COOH) | |
| D. | 向溶液中加入醋酸呈酸性,则一定是c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
17.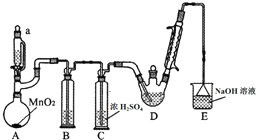 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH (三氯乙酸)+HCl
②相关物质的部分物理性质:
(1)装置B中盛放的试剂是饱和食盐水;装置E的作用是吸收多余氯气和氯化氢;
(2)若撤去装置C,可能导致装置D中副产物Cl3CCOOH、C2H5Cl(填化学式)的量增加;装置D可采用水浴加热的方法以控制反应温度在70℃左右.
(3)反应结束后,可采用蒸馏的方法从D中的混合物分离出CCl3COOH,除酒精灯、接液管、温度计、锥形瓶外,所需玻璃仪器有蒸馏烧瓶、冷凝管.
(4)测定产品纯度:称取产品0.30g配成待测溶液,加入0.1000mol/L碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.0200mol/LNa2S2O3溶液滴定至终点.进行平行实验后,测得消耗Na2S2O3溶液20.00mL.则产品的纯度为88.5%.(保留3位有效数字)
滴定的反应原理:
CCl3CHO+OH-→CHCl3+HCOO-
HCOO-+I2→H++2I-+CO2↑
I2+2S2O32-→2I-+S4O62-
(5)请设计实验方案证明三氯乙酸的酸性比乙酸强:分别测定0.1mol•L-1两种酸溶液的pH,三氯乙酸的pH较小,说明三氯乙酸酸性比乙酸的强.
 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH (三氯乙酸)+HCl
②相关物质的部分物理性质:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 熔点/℃ | -1 14.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水,可溶于乙醇 |
(2)若撤去装置C,可能导致装置D中副产物Cl3CCOOH、C2H5Cl(填化学式)的量增加;装置D可采用水浴加热的方法以控制反应温度在70℃左右.
(3)反应结束后,可采用蒸馏的方法从D中的混合物分离出CCl3COOH,除酒精灯、接液管、温度计、锥形瓶外,所需玻璃仪器有蒸馏烧瓶、冷凝管.
(4)测定产品纯度:称取产品0.30g配成待测溶液,加入0.1000mol/L碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.0200mol/LNa2S2O3溶液滴定至终点.进行平行实验后,测得消耗Na2S2O3溶液20.00mL.则产品的纯度为88.5%.(保留3位有效数字)
滴定的反应原理:
CCl3CHO+OH-→CHCl3+HCOO-
HCOO-+I2→H++2I-+CO2↑
I2+2S2O32-→2I-+S4O62-
(5)请设计实验方案证明三氯乙酸的酸性比乙酸强:分别测定0.1mol•L-1两种酸溶液的pH,三氯乙酸的pH较小,说明三氯乙酸酸性比乙酸的强.
14.下列由实验现象得出的结论正确的是( )
| 操作及现象 | 结论 | |
| A | 加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结. | NH4Cl固体可以升华 |
| B | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液,均有白色固体析出 | 蛋白质均发生变性 |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色. | Br-还原性强于Cl- |
| D | 将0.1mol•L-1MgSO4溶液滴入NaOH溶液至不再有白色沉淀产生,再滴加0.1mol•L-1FeCl3溶液,白色沉淀变为红褐色沉淀 | 在水中的溶解度 Mg(OH)2<Fe(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
1. NH4HSO4在水溶液中的电离方程式为:NH4HSO4=NH4++H++SO42-.现向100mL 0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示.下列说法中不正确的是( )
NH4HSO4在水溶液中的电离方程式为:NH4HSO4=NH4++H++SO42-.现向100mL 0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示.下列说法中不正确的是( )
 NH4HSO4在水溶液中的电离方程式为:NH4HSO4=NH4++H++SO42-.现向100mL 0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示.下列说法中不正确的是( )
NH4HSO4在水溶液中的电离方程式为:NH4HSO4=NH4++H++SO42-.现向100mL 0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示.下列说法中不正确的是( )| A. | a点的溶液中:c(SO42-)>c(NH4+)>c(H+)>c(Na+)>c(OH-) | |
| B. | b点的溶液中:c(Na+)=c(SO42-)>c(H+)>c(NH4+)>c(OH-) | |
| C. | c点的溶液中:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | d、e点对应溶液中,水电离程度大小关系是d>e |
11.下列说法不正确的是( )
| A. | 自然界中植物通过光合作用将太阳能转化为生物质能,而农村沼气池的建造、农作物制乙醇,都是有效的利用生物质能 | |
| B. | 纳米TiO2光触媒技术制成的“木地板精油”能将水气转化为活性氧,可以有效降解甲醛、苯、氨等居室污染物 | |
| C. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强酸、强碱都会“断路” | |
| D. | 同位素在医学显像、诊断和治疗,以及在改进农产品质量、增加产量等技术方面应用广泛 |
18.短周期主族元素X、Y、Z、W、M的原子序数依次增大,其中X与其它元素均不位于同一主族,Y和W的原子序数相差8,Y、Z、W三种原子的最外层电子数之和为16,X、Z的最高正价和最低负价的代数和均为0.下列说法正确的是( )
| A. | M的氢化物的水溶液能与W的钠盐溶液,反应得到W的氢化物,说明非金属性M>W | |
| B. | 原子半径的大小顺序:r(W)>r(Z)>r(Y) | |
| C. | Y与Z形成的化合物能与碱反应,但不能和任何酸反应 | |
| D. | X和Y,W和M均能形成原子个数比为1:1的分子 |
15.下列有关化学用语正确的是( )
| A. | 中子数为18的硫原子:${\;}_{16}^{34}$S | |
| B. | 氨分子的电子式: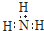 | |
| C. | 苯乙酸钠的结构简式: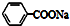 | |
| D. | H2SO3的电离方程式:H2SO3?2H++SO32- |
 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.