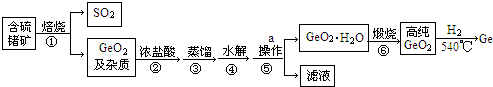
题目内容
利用如图1所示装置探究NO2能否被NH3还原(K1,K2为止水夹,夹持固定装置略去) 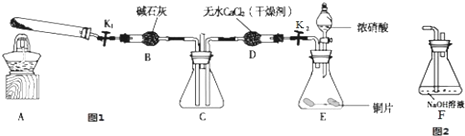
(1)若NO2能够被NH3还原,预期观察到C装置中的现象是 .
(2)实验过程中气密性良好,但未能观察到C装置中的预期现象.该小组同学分析其原因可能是:①还原性较弱,不能将NO2还原;②在此条件下,NO2的转化率极低;③ .
(3)NO2气体为常见的大气污染物之一,实验室制取NO2气体的反应原理为铜与浓硝酸反应,写出该反应的离子方程式 .

(1)若NO2能够被NH3还原,预期观察到C装置中的现象是
(2)实验过程中气密性良好,但未能观察到C装置中的预期现象.该小组同学分析其原因可能是:①还原性较弱,不能将NO2还原;②在此条件下,NO2的转化率极低;③
(3)NO2气体为常见的大气污染物之一,实验室制取NO2气体的反应原理为铜与浓硝酸反应,写出该反应的离子方程式
考点:性质实验方案的设计
专题:
分析:(1)若NO2能够被NH3还原,则混合气体的颜色将变浅;
(2)实验过程中,未能观察到C装置中的预期现象,说明二氧化氮反应的量很少,可能是反应速率降低,或者二氧化氮的转化率较低;
(3)铜和浓硝酸反应生成硝酸铜,二氧化氮和水,依据反应写出离子方程式;
(2)实验过程中,未能观察到C装置中的预期现象,说明二氧化氮反应的量很少,可能是反应速率降低,或者二氧化氮的转化率较低;
(3)铜和浓硝酸反应生成硝酸铜,二氧化氮和水,依据反应写出离子方程式;
解答:
解:(1)二氧化氮是红棕色气体,如果能被氨气还原,生成无色气体氮气,则C装置中混合气体颜色变浅,
故答案为:C装置中混合气体颜色变浅;
(3)造成未能观察到C装置中的预期现象可能原因是:在此条件下,该反应的化学反应速率极慢或NO2的转化率极低导致反应现象变化不明显,
故答案为:在此条件下,该反应的化学反应速率极慢;
(3)铜和浓硝酸反应生成硝酸铜,二氧化氮和水,反应写出离子方程式为;Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
故答案为:C装置中混合气体颜色变浅;
(3)造成未能观察到C装置中的预期现象可能原因是:在此条件下,该反应的化学反应速率极慢或NO2的转化率极低导致反应现象变化不明显,
故答案为:在此条件下,该反应的化学反应速率极慢;
(3)铜和浓硝酸反应生成硝酸铜,二氧化氮和水,反应写出离子方程式为;Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
点评:本题考查了氮及其化合物性质分析判断,主要是实验过程分析,硝酸性质应用,掌握基础是关键,题目难度中等.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
下列物质中属于非电解质的是( )
| A、NaOH |
| B、O2 |
| C、Na2CO3 |
| D、蔗糖 |
根据以下几个反应:①Cl2+2KBr=2KCl+Br2 ②Br2+2KI=2KBr+I2判断氧化性由强到弱的顺序是( )
| A、I2>Br2>Cl2 |
| B、Cl2>Br2>I2 |
| C、Br2>I2>Cl2 |
| D、Cl2>I2>Br2 |
 金属钾晶体为体心立方结构(如图所示),则在单位晶胞中钾原子的个数是( )
金属钾晶体为体心立方结构(如图所示),则在单位晶胞中钾原子的个数是( )| A、4 | B、3 | C、2 | D、1 |