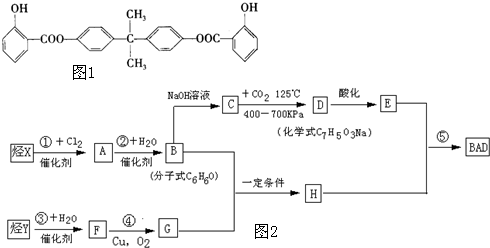
题目内容
(1)NaAlO2的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7 (填“>”、“=”、“<”),原因是(用离子方程式表示): .
(2)已知:AgCl+Br-=AgBr↓+Cl-,2AgI+S2-=Ag2S↓+2I-,AgBr+I-=AgI↓+Br-.由以上实验事实可知4种难溶银盐溶解度减小的顺序是 .
(2)已知:AgCl+Br-=AgBr↓+Cl-,2AgI+S2-=Ag2S↓+2I-,AgBr+I-=AgI↓+Br-.由以上实验事实可知4种难溶银盐溶解度减小的顺序是
考点:难溶电解质的溶解平衡及沉淀转化的本质,盐类水解的原理
专题:
分析:(1)偏铝酸根离子水解显碱性,发生AlO2-+2H2O?Al(OH)3+OH-;
(2)根据沉淀转化原理进行比较该4种难溶银盐溶解度大小;
(2)根据沉淀转化原理进行比较该4种难溶银盐溶解度大小;
解答:
解:(1)偏铝酸根离子水解显碱性,发生AlO2-+2H2O?Al(OH)3+OH-,常温下碱性溶液的pH>7,故答案为:碱;>;AlO2-+2H2O?Al(OH)3+OH-;
(2)根据沉淀转化原理:溶解度小的能转化为溶解度更小的,所以4种难溶银盐溶解度减小的顺序是:AgCl>AgBr>AgI>Ag2S,
故答案为:AgCl>AgBr>AgI>Ag2S;
(2)根据沉淀转化原理:溶解度小的能转化为溶解度更小的,所以4种难溶银盐溶解度减小的顺序是:AgCl>AgBr>AgI>Ag2S,
故答案为:AgCl>AgBr>AgI>Ag2S;
点评:本题考查盐类水解的原理及应用、难溶电解质的沉淀转化,涉及溶液酸碱性的判断等,注重基础知识的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是( )
| A | B | C | D | |
| 强电解质 | Fe | NaCl | CaCO3 | HNO3 |
| 弱电解质 | CH3COOH | NH3 | H3PO4 | Fe(OH)3 |
| 非电解质 | 蔗糖 | BaSO4 | 酒精 | H2O |
| A、A | B、B | C、C | D、D |
在一定温度下在某体积不变的容器中发生可逆反应:X2(气)+Y2(气)═2XY(气),达到平衡状态的标志是( )
| A、容器内的总压强不随时间变化 |
| B、X2的物质的量浓度不随时间变化 |
| C、X2、Y2、XY 的物质的量浓度之比为1:1:2 |
| D、单位时间内生成nmolX2,同时生成nmolY2 |
12 6 |
12 6 |
| A、12 | B、6 | C、18 | D、4 |
下列叙述正确的是( )
| A、氯化钠溶液在电流作用下电离成钠离子和氯离子 |
| B、溶于水后能电离出氢离子的化合物一定是酸 |
| C、硫酸钡难溶于水,但硫酸钡属于电解质 |
| D、二氧化碳溶于水后所得物质能部分电离,故二氧化碳属于电解质 |