题目内容
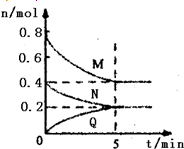 在容积为2L的恒容密闭容器中,一定温度下,发生反应:aM(g)+bN(g)?cQ(g).气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述正确的是( )
在容积为2L的恒容密闭容器中,一定温度下,发生反应:aM(g)+bN(g)?cQ(g).气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述正确的是( )A、该温度下此反应的平衡常数的值K=
| ||
| B、平衡时,M的转化率为50%,若条件改为恒温恒压,则达平衡时M的转化率小于50% | ||
| C、若开始时向容器中充入2mol M和1mol N,达到平衡时,M的体积分数小于50% | ||
| D、在5 min时,再向体系中充入少量He,重新达到平衡前v(正)>v(逆) |
考点:物质的量或浓度随时间的变化曲线
专题:
分析:根据物质物质的量的变化判断a、b、c数值,△n(M)=0.8mol-0.4mol=0.4mol,△n(N)=0.4mol-0.2mol=0.2mol,△n(Q)=0.2mol,所以a:b:c=2:1:1,化学方程式为2M(g)+N(g)?Q(g),
A.利用化学平衡常数表达式计算化学平衡常数;
B.反应2M(g)+N(g)?Q(g)为气体体积减小的反应,改为恒温恒压,平衡正向移动;
C.根据化学平衡移动的影响因素判断;
D.根据化学平衡移动判断.
A.利用化学平衡常数表达式计算化学平衡常数;
B.反应2M(g)+N(g)?Q(g)为气体体积减小的反应,改为恒温恒压,平衡正向移动;
C.根据化学平衡移动的影响因素判断;
D.根据化学平衡移动判断.
解答:
解:△n(M)=0.8mol-0.4mol=0.4mol,△n(N)=0.4mol-0.2mol=0.2mol,△n(Q)=0.2mol,所以a:b:c=2:1:1,化学方程式为2M(g)+N(g)?Q(g),
A.平衡时,c(M)=
=0.2mol/L,c(N)=c(Q)=
=0.1mol/L,K=
=
=25,故A错误;
B.反应2M(g)+N(g)?Q(g)为气体体积减小的反应,改为恒温恒压,平衡正向移动,M的转化率大于50%,故B错误;
C.在该条件下,M的体积分数为:
×100%=50%,由于该反应前气体体积大于反应后气体体积,充入比原反应更多的反应物时,可逆反应进行程度比原平衡大,所以M的体积分数小于50%,故C正确;
D.向体系中充入少量He,化学平衡不移动,即v(正)=v(逆),故D错误.
故选:C.
A.平衡时,c(M)=
| 0.4mol |
| 2L |
| 0.2mol |
| 2L |
| c(Q) |
| c2(M)?c(N) |
| 0.1 |
| 0.22×0.1 |
B.反应2M(g)+N(g)?Q(g)为气体体积减小的反应,改为恒温恒压,平衡正向移动,M的转化率大于50%,故B错误;
C.在该条件下,M的体积分数为:
| 0.2mol |
| 0.2mol+0.1mol+0.1mol |
D.向体系中充入少量He,化学平衡不移动,即v(正)=v(逆),故D错误.
故选:C.
点评:本题考查化学平衡图象、影响平衡的因素、平衡常数影响因素、化学反应速率的计算等,难度不大,注意掌握平衡移动原理.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
人体摄入二氧化硫浓度太高,会刺激呼吸系统,导致支气管炎、肺通气功能和免疫功能下降等.关于SO2的叙述中,正确的是( )
| A、SO2熏蒸的“雪耳”炖不烂,对人体有害 |
| B、SO2是酸性氧化物,溶于水得稳定的亚硫酸 |
| C、SO2气体通入NaOH溶液一定得到Na2SO3 |
| D、SO2气体通入紫色石蕊溶液中,溶液先变红后褪色 |
用NA表示阿伏加德罗常数,n表示物质的量,N表示微粒数.下列各项正确的是( )
| A、常温常压下,1mol氦气含有的原子数为NA |
| B、0.10 mol?L-1 NaCl溶液中含有Cl-离子数是0.1 NA |
| C、NA个O2分子的质量是16 g |
| D、标准状况下,22.4 L水中含有的水分子数是NA |
下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是( )
①Al ②AlCl3 ③Al(OH)3 ④(NH4)2CO3.
①Al ②AlCl3 ③Al(OH)3 ④(NH4)2CO3.
| A、③④ | B、②③④ |
| C、①③④ | D、全部 |
对于反应2NO2(g)?N2O4(g)达到平衡后,在温度不变时欲使
比值增大,可以采取( )
| c(NO2) |
| c(N2O4) |
| A、体积不变,增加NO2的量 |
| B、体积不变,增加N2O4的量 |
| C、使体积扩大到原来的2倍 |
| D、使体积不变充入N2 |
将4mol SO2与2mol O2放入4L的密闭容器中,在一定条件下反应达到平衡:2SO2(g)+O2(g)?2SO3(g),测得平衡时SO3的浓度为0.5mol?L-1.则此条件下的平衡常数K( )
| A、4 | B、0.25 |
| C、0.4 | D、0.2 |
几种短周期元素的原子半径及某些化合价见下表.分析判断下列说法正确的是( )
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | -1 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A、A、H、J的离子半径由大到小顺序是A>J>H |
| B、A的单质能将E单质从HE3的溶液中置换出来 |
| C、G元素的单质不存在同素异形体 |
| D、I在DB2中燃烧生成两种化合物 |
张青莲是我国著名的化学家,1991年他准确测得In的相对原子质量为114.818,被国际相对原子质量委员会采用为新的标准值.这是相对原子质量表中首次采用我国测定的相对原子质量值.则下列关于
In的说法中,错误的是( )
115 49 |
A、
| ||
B、
| ||
C、
| ||
D、
|
