题目内容
将4mol SO2与2mol O2放入4L的密闭容器中,在一定条件下反应达到平衡:2SO2(g)+O2(g)?2SO3(g),测得平衡时SO3的浓度为0.5mol?L-1.则此条件下的平衡常数K( )
| A、4 | B、0.25 |
| C、0.4 | D、0.2 |
考点:化学平衡常数的含义
专题:
分析:利用化学平衡三段式计算各组分的浓度,根据平衡常数公式K=
计算出该反应的平衡常数.
| c2(SO3) |
| c2(SO2)?c(O2) |
解答:
解:平衡时SO3的浓度为0.5mol?L-1,则平衡时各组成物质的量变化为:
2SO2(g)+O2(g)?2SO3(g),
起始量(mol?L-1) 1 0.5 0
变化量(mol?L-1) 0.5 0.25 0.5
平衡量(mol?L-1) 0.5 0.25 0.5
平衡常数K=
=
=4,
故选:A.
2SO2(g)+O2(g)?2SO3(g),
起始量(mol?L-1) 1 0.5 0
变化量(mol?L-1) 0.5 0.25 0.5
平衡量(mol?L-1) 0.5 0.25 0.5
平衡常数K=
| c2(SO3) |
| c2(SO2)?c(O2) |
| 0.52 |
| 0.52×0.25 |
故选:A.
点评:本题考查了化学平衡常数考点,题目难度中等,注意平衡常数在计算中的应用.

练习册系列答案
相关题目
设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A、0.1molN2与0.3molH2在密闭容器催化剂作用下充分反应,生成氨分子数为0.2NA |
| B、标准状况下,11.2L甲醛气体中电子数为8NA |
| C、常温常压下,7.8g苯中含有单键的数目为0.9NA |
| D、1L浓度为1mol?L-1的Na2CO3溶液中含有NA个CO32- |
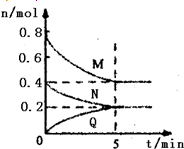 在容积为2L的恒容密闭容器中,一定温度下,发生反应:aM(g)+bN(g)?cQ(g).气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述正确的是( )
在容积为2L的恒容密闭容器中,一定温度下,发生反应:aM(g)+bN(g)?cQ(g).气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述正确的是( )A、该温度下此反应的平衡常数的值K=
| ||
| B、平衡时,M的转化率为50%,若条件改为恒温恒压,则达平衡时M的转化率小于50% | ||
| C、若开始时向容器中充入2mol M和1mol N,达到平衡时,M的体积分数小于50% | ||
| D、在5 min时,再向体系中充入少量He,重新达到平衡前v(正)>v(逆) |
对于可逆反应C(s)+H2O(g)?CO(g)+H2(g),在一定温度下达到平衡时,其平衡常数表达式正确的是( )
A、K=
| ||
B、K=
| ||
C、K=
| ||
D、K=
|
已知如下氧化还原反应2BrO3-+Cl2=Br2+2ClO3- 5Cl2+I2+6H2O=2HIO3+10HCl ClO3-+5Cl-+6H+=3Cl2+3H2O
则下列各微粒氧化能力强弱顺序正确的是( )
则下列各微粒氧化能力强弱顺序正确的是( )
| A、ClO3->BrO3->IO3->Cl2 |
| B、BrO3->Cl2>ClO3->IO3- |
| C、BrO3->ClO3->Cl2>IO3- |
| D、Cl2>BrO3->ClO3->IO3- |
下列叙述中正确的是( )
| A、1molO2的质量为32g/mol |
| B、SO42- 的摩尔质量是96g/mol |
| C、1mol任何物质的质量等于该物质的相对分子质量 |
| D、二氧化碳的摩尔质量44g |