题目内容
几种短周期元素的原子半径及某些化合价见下表.分析判断下列说法正确的是( )
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | -1 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A、A、H、J的离子半径由大到小顺序是A>J>H |
| B、A的单质能将E单质从HE3的溶液中置换出来 |
| C、G元素的单质不存在同素异形体 |
| D、I在DB2中燃烧生成两种化合物 |
考点:原子结构与元素的性质
专题:
分析:根据元素的最高正价=最外层电子数,最高正价+|最低负价|=8,最低负价=最外层电子数-8,同周期元素原子从左到右原子半径逐渐减小,同主族元素原子半径从上到下逐渐增大,可推知:A为F,B为O,D为C、E为Cl,G为P;H为Al,I为Be,J为Na
A、电子层越多,半径越大,电子层一样,核电荷数越大半径越小;
B、得电子能力强的非金属单质能置换得电子能力弱的;
C、同素异形体是同种元素组成的性质不同的单质之间的互称;
D、同主族元素具有相似性.
A、电子层越多,半径越大,电子层一样,核电荷数越大半径越小;
B、得电子能力强的非金属单质能置换得电子能力弱的;
C、同素异形体是同种元素组成的性质不同的单质之间的互称;
D、同主族元素具有相似性.
解答:
解:根据元素的最高正价=最外层电子数,最高正价+|最低负价|=8,最低负价=最外层电子数-8,同周期元素原子从左到右原子半径逐渐减小,同主族元素原子半径从上到下逐渐增大,可推知:A为F,B为O,D为C、E为Cl,G为P;H为Al,I为Be,J为Na,
A、A、J、H分别为F、Na、Al,它们的离子核外电子层数相等,离子半径大小顺序为:F->Na+>Al3+,故A正确;
B、F2极易和水反应置换出氧气,则A的单质不能将E单质从HE的溶液中置换出来,故B错误;
C、红磷和白磷互为同素异形体,故C错误;
D、金属铍和镁性质相似,在二氧化碳中的燃烧生成氧化铍和碳单质,故D错误.
故选A.
A、A、J、H分别为F、Na、Al,它们的离子核外电子层数相等,离子半径大小顺序为:F->Na+>Al3+,故A正确;
B、F2极易和水反应置换出氧气,则A的单质不能将E单质从HE的溶液中置换出来,故B错误;
C、红磷和白磷互为同素异形体,故C错误;
D、金属铍和镁性质相似,在二氧化碳中的燃烧生成氧化铍和碳单质,故D错误.
故选A.
点评:本题考查了元素周期律的知识,要求学生熟记教材知识,学以致用,题目难度不大,注意元素化合价与原子最外层电子数的关系..

练习册系列答案
相关题目
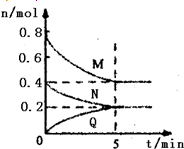 在容积为2L的恒容密闭容器中,一定温度下,发生反应:aM(g)+bN(g)?cQ(g).气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述正确的是( )
在容积为2L的恒容密闭容器中,一定温度下,发生反应:aM(g)+bN(g)?cQ(g).气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述正确的是( )A、该温度下此反应的平衡常数的值K=
| ||
| B、平衡时,M的转化率为50%,若条件改为恒温恒压,则达平衡时M的转化率小于50% | ||
| C、若开始时向容器中充入2mol M和1mol N,达到平衡时,M的体积分数小于50% | ||
| D、在5 min时,再向体系中充入少量He,重新达到平衡前v(正)>v(逆) |
已知如下氧化还原反应2BrO3-+Cl2=Br2+2ClO3- 5Cl2+I2+6H2O=2HIO3+10HCl ClO3-+5Cl-+6H+=3Cl2+3H2O
则下列各微粒氧化能力强弱顺序正确的是( )
则下列各微粒氧化能力强弱顺序正确的是( )
| A、ClO3->BrO3->IO3->Cl2 |
| B、BrO3->Cl2>ClO3->IO3- |
| C、BrO3->ClO3->Cl2>IO3- |
| D、Cl2>BrO3->ClO3->IO3- |
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO,其过程如下:下列说法不正确的是( )
mCeO2
(m-x)CeO2?xCe+xO2
(m-x)CeO2?Ce+xH2O+xCO2
mCeO2+xH2+xCO.
mCeO2
| 太阳能 |
| ① |
(m-x)CeO2?Ce+xH2O+xCO2
| 900℃ |
| ② |
A、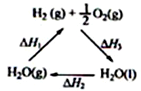 图中△H1=△H2+△H3 |
| B、该过程实现了太阳能向化学能的转化 |
| C、该过程中CeO2没有消耗 |
| D、H2O(l)=H2O(g)此过程中,△H>0 |
 (1)已知下列两个热化学方程式:
(1)已知下列两个热化学方程式: