题目内容
16.两种金属混合物共15g,投入足量的盐酸中,充分反应得11.2L H2(标准状况),则原混合物组成中肯定不能为下列的( )| A. | Mg、Ag | B. | Fe、Zn | C. | Al、Fe | D. | Mg、Fe |
分析 假设金属均为+2价,金属总物质的量等于氢气物质的量,根据n=$\frac{m}{M}$计算混合金属平均摩尔质量,因为两种金属的混合物,故平均摩尔质量应介于各组分之间,根据电子转移守恒,若金属不与盐酸反应,其摩尔质量可以视作无穷大.若反应中金属不表现+2价,按化合价比例关系折算金属的相应摩尔质量.
解答 解:标况下11.2L氢气物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,假设金属均为+2价,金属总物质的量等于氢气物质的量,故混合金属平均摩尔质量为:$\frac{15g}{0.5mol}$=30g/mol,因为两种金属的混合物,故平均摩尔质量应介于各组分之间.
A.Mg的摩尔质量为24g/mol,Ag不与盐酸反应,其摩尔质量可以视作无穷大,二者的平均摩尔质量可以是30g/mol,符合题意,故A错误;
B.Zn的摩尔质量为65g/mol,Fe与盐酸反应表现+2价,摩尔质量为56g/mol,均大于30g/mol,不符合题意,故B正确;
C.Al为+2价时的摩尔质量为:$\frac{2}{3}$×27g/mol=18g/mol,Fe与盐酸反应表现+2价,摩尔质量为56g/mol,二者的平均摩尔质量可以是30g/mol,符合题意,故C错误;
D.Mg的摩尔质量为24g/mol,Fe与盐酸反应表现+2价,摩尔质量为56g/mol,二者的平均摩尔质量可以是30g/mol,符合题意,故D错误,
故选:B.
点评 本题考查混合物有关计算,题目难度中等,侧重考查学生的分析、理解能力及化学计算能力,注意利用平均值解答,也可以利用极值法进行解答.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案
相关题目
7.下列除杂质的操作中不正确的是( )
| A. | SO2中混有HCl:将其通入Na2SO3溶液 | |
| B. | NaHCO3溶液中混有少量的Na2CO3:往该溶液中通入过量的CO2气体 | |
| C. | 铁粉中混有铝粉:加入过量烧碱溶液充分反应、过滤 | |
| D. | FeCl2溶液中混有少量FeCl3:加入适量铁粉 |
11.下列有关反应的离子方程式书写正确的是( )
| A. | 用铁片与稀盐酸制取H2:2Fe+6H+═2Fe3++3H2↑ | |
| B. | HNO3溶液中加入NaOH溶液:H++OH-═H2O | |
| C. | 向硫酸铁溶液中加入铁钉:Fe3++Fe═2Fe2+ | |
| D. | 向AlCl3溶液中加入过量NH3•H2O:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
1.近年来,人们利用合成的方法制备了多种具有特殊结构的有机物,例如分子具有以下立体结构的环状化合物(其中氢原子均已略去).有人认为上述有机物中:①立方烷、棱晶烷、金刚烷都是烷烃的同系物②盆烯能与溴水发生加成反应③棱晶烷、盆烯都是苯的同分异构体④立方烷的二氯代物有3种同分异构体⑤金刚烷是癸烷的同分异构体.你认为上述判断中正确的是( )


| A. | 只有③ | B. | ②③ | C. | ①③⑤ | D. | ②③④ |
8.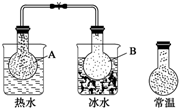 已知反应:2NO2(g)?N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用夹子夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法错误的是( )
已知反应:2NO2(g)?N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用夹子夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法错误的是( )
 已知反应:2NO2(g)?N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用夹子夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法错误的是( )
已知反应:2NO2(g)?N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用夹子夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法错误的是( )| A. | 反应2NO2(g)?N2O4(g)的正反应为吸热反应 | |
| B. | 上述过程中,A烧瓶内正、逆反应速率均加快 | |
| C. | 上述过程中,B烧瓶内c(NO2)减小,c(N2O4)增大 | |
| D. | 上述过程中,A、B烧瓶内气体密度均保持不变 |
5.下列溶液中能够区别SO2和CO2气体的是( )
①澄清石灰水 ②H2S溶液 ③KMnO4酸性溶液 ④NaHCO3溶液 ⑤品红溶液.
①澄清石灰水 ②H2S溶液 ③KMnO4酸性溶液 ④NaHCO3溶液 ⑤品红溶液.
| A. | 只有①②③ | B. | 只有②③⑤ | C. | ②③④⑤ | D. | ①②③⑤ |
6.下列实验中,用错试剂的是( )
| A. | 用稀盐酸清洗做焰色反应的铂丝 | B. | 用酒精萃取碘水中的碘 | ||
| C. | 用稀硝酸洗去残留在试管壁上的铜 | D. | 用氢氟酸刻蚀玻璃 |
