题目内容
2.某晶体中含有极性键,关于该晶体的说法错误的是( )| A. | 不可能有很高的熔沸点 | B. | 不可能是金属晶体 | ||
| C. | 可能是有机物 | D. | 可能是离子晶体 |
分析 一般不同非金属元素之间易形成极性键,已知某晶体中含有极性键,则该晶体为化合物,可能是离子化合物、共价化合物,结合不同类型晶体的性质分析.
解答 解:A.在SiO2晶体中含有极性共价键Si-O键,由于该晶体的原子晶体,原子之间通过共价键结合,断裂需要吸收很高的能量,因此该物质的熔沸点很高,故A错误;B.同种元素的原子形成的共价键是非极性共价键,不同种元素的原子形成的共价键是极性共价键,因此含有极性键的物质不可能是单质,故B正确;
C.若该极性键存在于含有C元素的化合物,如CH4、CH3CH2OH等,则相应的物质是有机物,故C正确;
D.离子化合物中一定含有离子键,可能含有极性共价键,如NaOH,也可能含有非极性共价键,如Na2O2,因此含有极性键的化合物可能是离子晶体,故D正确;
故选A.
点评 本题考查了极性键、晶体的类型,题目难度不大,注意离子晶体中一定含有离子键可能含有共价键,题目难度不大,注意利用举例法分析.

练习册系列答案
相关题目
16.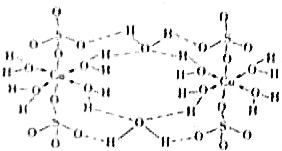 下列说法正确的是( )
下列说法正确的是( )
 下列说法正确的是( )
下列说法正确的是( )| A. | 在如图结构示意图中,所有氧原子都采用sp3杂化 | |
| B. | 在如图结构示意图中,存在配位键、共价键和离子键 | |
| C. | 胆矾是分子晶体,分子间存在氢键 | |
| D. | 胆矾中的水在不同温度下会分步失去 |
10.某有机物A是农药生产中的一种中间体,其结构简式如图,下列叙述中正确的( )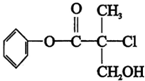

| A. | 有机物A属于芳香烃 | |
| B. | 有机物A可以和Br的CCl4溶液发生加成反应 | |
| C. | 有机物A和浓硫酸混合加热,可以发生消去反应 | |
| D. | 有机物A可与NaOH溶液反应,生成多种可溶于水的化合物 |
17.勒沙特列原理是自然界一条重要的基本原理.下列事实不能用勒沙特列原理解释的是( )
| A. | NO2气体受压缩后,颜色先变深后变浅 | |
| B. | 对2HI(g)?H2(g)+I2(g)平衡体系加压,颜色迅速变深 | |
| C. | 合成氨工业采用高温、高压工艺提高氨的产率 | |
| D. | 配制硫酸亚铁溶液时,常加入少量铁屑防止氧化 |
7.某温度下,将0.1mol/L的HCl溶液稀释到0.01mol/L,下列说法正确的是( )
| A. | 水的电离程度不变 | B. | pH值变大 | ||
| C. | 稀释过程中,所有离子浓度均变小 | D. | 稀释过程中Kw逐渐变小 |
14.50mL的酸式滴定管中,某浓度HCl溶液在30mL处,则该HCl溶液的体积为( )
| A. | 大于30mL | B. | 等于30mL | C. | 大于20mL | D. | 等于20mL |
11.下列物质的水溶液能导电,但属于非电解质的是( )
| A. | AlCl3 | B. | Cl2 | C. | NaHCO3 | D. | CO2 |