题目内容
7.某温度下,将0.1mol/L的HCl溶液稀释到0.01mol/L,下列说法正确的是( )| A. | 水的电离程度不变 | B. | pH值变大 | ||
| C. | 稀释过程中,所有离子浓度均变小 | D. | 稀释过程中Kw逐渐变小 |
分析 A.某温度下,将0.1mol/L的HCl溶液稀释到0.01mol/L,氢离子浓度减小,对水电离的抑制程度减小;
B.稀释溶液氢离子浓度减小,PH增大;
C.稀释过程中氢离子浓度减小,氢氧根离子浓度增大;
D.Kw随温度变化,不随浓度变化;
解答 解:A.某温度下,将0.1mol/L的HCl溶液稀释到0.01mol/L,氢离子浓度减小,对水电离的抑制程度减小,相对而言水的电离程度增大,故A错误;
B.稀释溶液氢离子浓度减小,PH=-lgc(H+),所以PH增大,故B正确;
C.稀释过程中氢离子浓度减小,溶液中存在离子积常数,氢氧根离子浓度增大,故C错误;
D.Kw随温度变化,不随浓度变化,稀释过程中Kw不变,故D错误;
故选B.
点评 本题考查了影响水的电离平衡的因素分析判断,注意溶液中氢离子浓度和氢氧根离子浓度乘积为常数,只随温度发生改变,题目较简单.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
1.恒温下,在一密闭容器中,N2(g)+3H2(g)?2NH3(g)达到平衡后,测得c(H2)=2mol•L-1,N2的体积分数为20%,下列有关说法中正确的是( )
| A. | 将容器容积压缩一半,平衡向右移动,达到新平衡时c(H2)<2mol•L-1 | |
| B. | 向容器中加入0.1molN2,平衡向右移动,达到新平衡时N2的体积分数小于20% | |
| C. | 若达到新平衡时c(H2)=2.5mol•L-1,则改变的条件可能是降温或加压 | |
| D. | 若改变条件后,H2的百分含量增大,则平衡一定向逆反应方向移动 |
18.下列实验装置不能达到实验目的是( )
| A. | 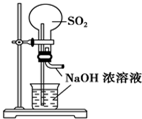 用SO2做喷泉实验 | B. | 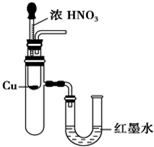 验证CU与浓HNO3反应的热量变化 | ||
| C. | 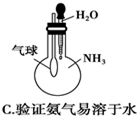 验证氨气易溶于水 | D. | 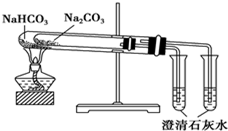 比较Na2CO3与NaHCO3的稳定性 |
15.下列操作不能达到实验目的是( )

| A. | ①检验某物质中是否含有钾元素 | B. | ②制备氢氧化亚铁并观察其颜色 | ||
| C. | ③分离水和乙醇 | D. | ④用CCl4萃取碘水中的碘 |
2.某晶体中含有极性键,关于该晶体的说法错误的是( )
| A. | 不可能有很高的熔沸点 | B. | 不可能是金属晶体 | ||
| C. | 可能是有机物 | D. | 可能是离子晶体 |
19.下列说法正确的是( )
| A. | 氯化氢水溶液能导电,所以氯化氢是电解质 | |
| B. | 铜丝能导电,所以铜是电解质 | |
| C. | 固体氯化钠不导电,所以氯化钠是非电解质 | |
| D. | CO2的水溶液能导电,所以CO2是电解质 |
16.关于下列各装置图的叙述中,正确的是( )


| A. | 若采用装置①精炼铜,则a极为纯铜,b极为粗铜,电解质溶液为CuSO4溶液 | |
| B. | 装置②是原电池,工作时SO42-离子向铜极移动 | |
| C. | 装置③中X若为四氯化碳,则此装置可用于吸收氨气,并防止倒吸 | |
| D. | 装置④可用于实验室配置一定物质的量浓度的稀硫酸 |
17.化学无处不在,下列与化学有关的说法不正确的是( )
| A. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| B. | 工业上以氯气和石灰乳为原料制备漂白粉 | |
| C. | 单质硅常用做光导纤维的材料,这与硅的半导体性能有一定关系 | |
| D. | 高压钠灯发出的黄光射程远、透雾能力强,常用做路灯 |